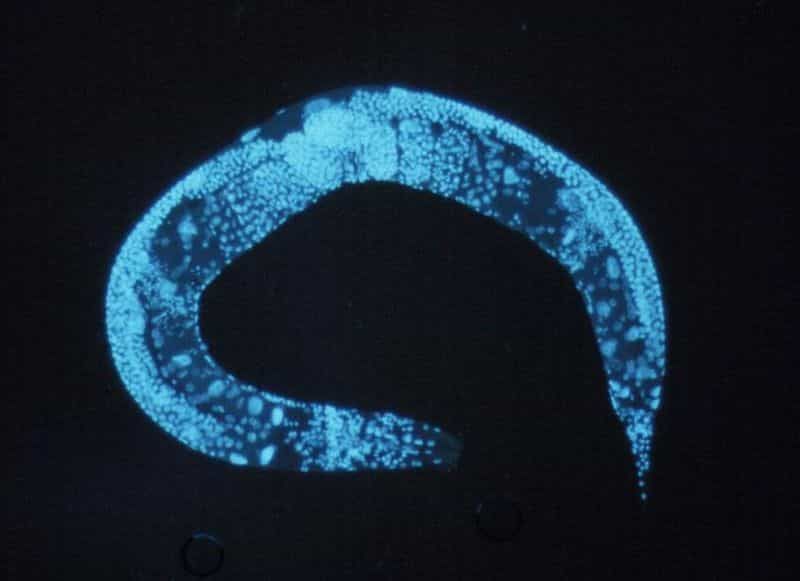
La star de la revue Nature methods, dont deux articles dédiés sont parus simultanément le 16 janvier, est un petit ver d'un millimètre de long, Caenorhabditis elegansCaenorhabditis elegans, un modèle d'étude très prisé des biologistes. Cette fois, c'est son système nerveux qui est sous la lumièrelumière des projecteursprojecteurs. Grâce à la technique d'optogénétique (alliant l'optique et la génétique), certaines cellules ont pu être spécifiquement activées et le ver lui-même téléguidé par la lumière, permettant ainsi de mieux comprendre l'organisation du système nerveux du ver et comment les cellules sont interconnectées pour permettre le mouvementmouvement.
L'optogénétique n'est pas nouvelle et des souris possédant une fibre optiquefibre optique implantée dans leur cerveau étaient déjà sous l'emprise de la lumière, qui leur donnait l'ordre de tourner en rond. Mais le ver, animal transparenttransparent composé ni plus ni moins de 959 cellules dont 302 neurones, a fourni un outil parfait pour tenter de rendre l'optogénétique bien plus précise qu'elle ne l'était auparavant.
L’optogénétique, en encore mieux
En effet, cette fois-ci, plus besoin d'utiliser de fibre optique. Grâce à la nouvelle technique dénommée Colbert (Controlling Locomotion and Behavior in Real-Time, pour contrôler le mouvement et le comportement en temps-réel), un laserlaser suffisamment précis permet d'envoyer de la lumière sur une partie bien localisée du système nerveux du ver.
Les mouvements du ver sont inactivés par la lumière verte. © Université de Harvard/Vimeo
Le programme informatique, mis au point par l'équipe de l'Université de Harvard, localise le ver filmé au microscopemicroscope, le suit au cours de son déplacement, diffuse un rayon lumineux sur une partie précise du ver et maintient le rayon sur la même zone malgré ses mouvements. Le programme est très rapide puisqu'il remet à jour la position du rayon 50 fois par seconde, soit toutes les 20 millisecondes, et très précis puisqu'il vise avec une résolutionrésolution de 30 micromètresmicromètres.
Mais cela ne fonctionne pas sur n'importe quel ver : il faut préalablement modifier génétiquement certaines cellules en apportant les gènes codant pour la channelrhodopsinechannelrhodopsine ou l'halorhodopsine. Ces deux protéinesprotéines, en forme de canaux ancrés dans la membrane cellulairemembrane cellulaire, ont la particularité de s'ouvrir ou de se fermer sous l'influence de la lumière. Alors que la channelrhodopsine s'ouvre sous la lumière bleuelumière bleue, provoquant l'activation de la cellule neuronale, l'halorhodopsine se ferme sous la lumière verte en inactivant la cellule.
Pondre des œufs sur commande
L'utilisation des deux protéines dans des cellules particulières et à l'aide de lasers à des longueurs d'ondelongueurs d'onde adaptées offre en théorie un panel de possibilités d'activation et de désactivation des cellules, menant les scientifiques à faire du ver un vrai pantin. En pratique, c'est tout aussi fascinant ! Selon le type de lumière ou les cellules neuronales ciblées, le ver est tour à tour paralysé, forcé à pondre des œufs, à revenir en arrière ou à accélérer.
Le ver pond des œufs grâce à la lumière bleue (à partir du temps affiché 8828). © Université de Harvard/Vimeo
Le second article, publié par une équipe du Georgia Institute of Technology à Atlanta, expose une technologie basée sur le même principe, un peu moins rapide (40 millisecondes) mais permettant un positionnement plus précis du laser coloré. En ciblant la tête du ver à l'aide d'une lumière bleue à intervalles réguliers, l'animal est amené à effectuer des rotations successives et à avancer selon des trajectoires en triangle.
En plus du côté amusant de ces technologies, il ne faut pas oublier qu'elles peuvent servir d'outils à la compréhension de l'organisation des circuits neuronaux. Sachant que l'Homme possède des milliards de neurones, quoi de mieux pour commencer que de s'intéresser à des animaux qui en possèdent un peu moins ?