au sommaire
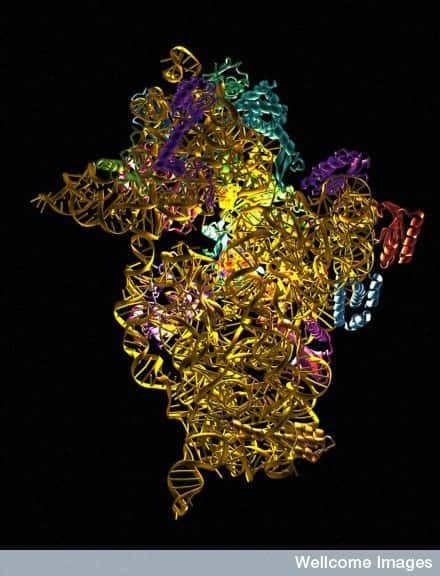
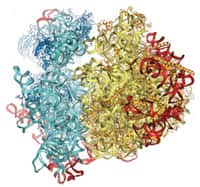
La compréhension de la structure du ribosome permet de mieux connaître les effets des antibiotiques lorsqu’ils se fixent à lui. © Wellcome Images, Flickr, CC by-nc-nd 2.0
Les ribosomes sont de grands complexes constitués de protéines et d'ARN repliés ensemble. Présents au sein des cellules de tous les êtres vivants, ils interviennent comme des « nanomachineries » moléculaires dans l'expression des gènes et la biosynthèse des protéines. La structure des ribosomes de différentes espècesespèces était déjà précisément connue à l'échelle atomique. Déterminer celle particulièrement complexe du ribosome humain restait toutefois un défi majeur à relever.
L'équipe de Bruno Klaholz, à l'IGBMC (CNRS, université de Strasbourg, Inserm) vient de visualiser la structure atomique du ribosome humain complet avec une résolutionrésolution supérieure à trois angströms (0,3 nanomètrenanomètre). Le modèle obtenu représente les 220.000 atomesatomes qui constituent les deux sous-unités du ribosome et permet, pour la première fois, d'explorer son agencement en détail, de voir et d'identifier les différents acides aminés et nucléotidesnucléotides en trois dimensions.
Les chercheurs se sont plus particulièrement intéressés aux différents sites de liaison et aux interactions fines qui y ont lieu. Leurs travaux révèlent par exemple qu'après avoir livré les acides aminés qu'ils transportaient, les ARN de transfert continuent à interagir avec le ribosome dans un site particulier (le site de sortie des ARNt, les acides ribonucléiques de transfertacides ribonucléiques de transfert). Ils mettent également en lumièrelumière la dynamique des deux sous-unités du ribosome qui tournent légèrement sur elles-mêmes au cours du processus de biosynthèse des protéines, entraînant un fort remodelage de la configuration 3D de la structure à leur interface.
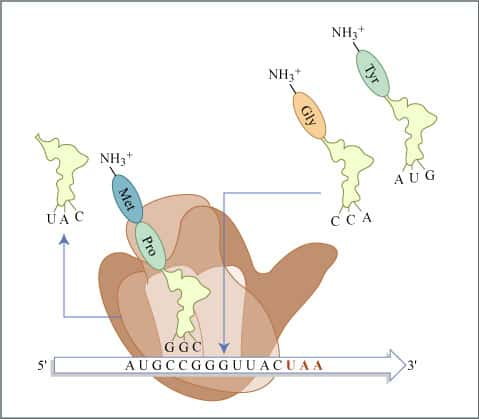
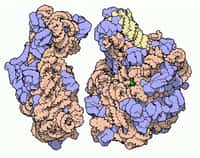
Lors de la traduction de l’ARN, le ribosome associe un acide aminé à chaque codon (triplet de nucléotides). © MIT OpenCourseWare, Flickr, CC by-nc-sa 4.0
Étudier les effets secondaires de certains antibiotiques
Ces résultats publiés dans Nature ont été rendus possibles par un ensemble de technologies de pointe. Les échantillons, hautement purifiés puis congelés, ont été visualisés par cryomicroscopie électroniquecryomicroscopie électronique. Cette méthode permet de travailler sur des objets figés dont l'orientation ne change pas et dont la structure et les fonctions biologiques sont préservées. Une combinaison de traitement d'images et de reconstruction 3D appliquée aux images obtenues par le cryomicroscope électronique nouvelle génération de l'IGBMC (un appareil unique en France) a abouti à ce degré de précision rare.
Cette connaissance fine de la structure et de la dynamique du ribosome humain complet ouvre la voie à de nouvelles explorations majeures. Il est désormais envisageable d'étudier les effets secondaires de certains antibiotiques comme ceux destinés à s'attaquer aux ribosomes bactériens et qui peuvent en réalité cibler « par erreur » le ribosome humain. La constitution d'un répertoire des sites de liaison existants est une première étape pour augmenter la spécificité des moléculesmolécules thérapeutiques et éviter qu'elles ne se fixent au mauvais endroit.
À terme, ces résultats pourront également être utilisés pour la mise au point de traitement de maladies liées aux dysfonctionnements du ribosome et à la dérégulation de la synthèse des protéines. Dans le cas des cancers par exemple, pouvoir cibler les ribosomes des cellules malades permettrait de réduire leurs taux de synthèse de protéines.