au sommaire
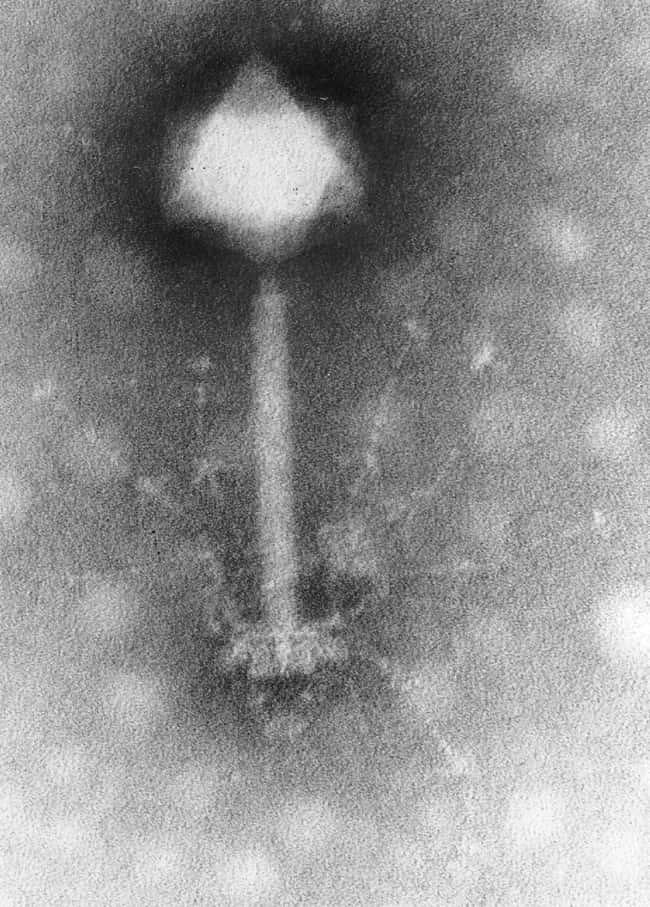
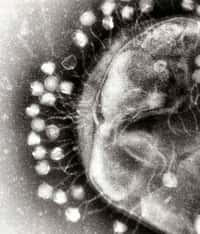
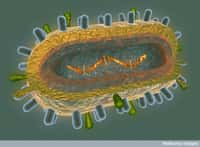
Un bactériophage est un virus qui s'attaque aux bactéries. Hauts en moyenne de 200 nm, ces virus adoptent cette conformation typique qui les fait ressembler à des robots miniatures. En haut, la tête, qui contient le patrimoine génétique, suivie d'une queue grâce à laquelle il s'attache aux bactéries. En quelques jours, il est capable de muter pour s'adapter à des changements environnementaux. © Plos, Wikipédia, cc by sa 2.5
- Tout savoir sur les virus grâce à notre dossier complet

Les travaux de l'équipe néerlandaise dirigée par Ron Fouchier ne cessent de faire polémique. Après avoir annoncé qu'ils avaient créé dans leur laboratoire un virus de la grippe aviaire H5N1 susceptible d'être très contagieuxcontagieux et très mortel après seulement 5 mutations de la souche naturelle, les autorités sanitaires américaines avaient appelé les magazines spécialisés à s'abstenir de publier certains passages jugés délicats, par peur de bioterrorisme.
Désormais, 39 virologistes, dont ceux impliqués dans ces travaux, ont écrit une lettre dans laquelle ils annoncent arrêter leurs recherches sur ce virus durant les deux prochains mois afin de lancer un grand débat international sur le sujet.
Or, une étude tout à fait indépendante et publiée le 26 janvier dans Science, pourrait bien remettre un peu d'huile sur le feufeu, malgré elle. Des chercheurs de l'université d'État du Michigan (États-Unis) ont pu montrer qu'un virus tueur de bactéries, rendu inoffensif, pouvait retrouver son pouvoir meurtrier en 12 jours grâce à l'intervention de 4 mutations dans son génome. Précisons qu'il n'est pas inquiétant pour l'Homme.

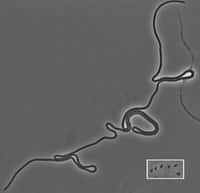
Justin Meyer, premier auteur de l'étude, observe la survie des bactéries Escherichia coli dans ses boîtes de Petri. On aperçoit que certaines cases sont vides, preuve que le bactériophage lambda est venu à bout de ses hôtes. Dans d'autres en revanche, les bactéries se portent bien. © MichiganStateU, Youtube
Un virus tueur qui sait s’adapter en 12 jours
Le coupable : le bactériophage lambda. C'est un virus à ADNADN double brindouble brin spécialisé dans le parasitisme d'une célèbre bactérie : Escherichia coli. Pour infester sa victime, il utilise une protéineprotéine, appelée J, pour venir se fixer au récepteur membranaire LamB, sa seule porteporte d'entrée, avant d'y injecter son génome et de parasiter son hôte.
Les chercheurs américains ont alors voulu voir ce qu'il arriverait à ce lambda s'ils changeaient le verrouverrou en éteignant le gènegène à l'origine de LamB chez la bactérie. Ils disposaient pour cela de 96 colonies d'Escherichia coliEscherichia coli génétiquement modifiées, qui ont été confrontées à leur ennemi le plus intime.
Dans 24 boîtes de culture, le virus est redevenu infectieux au bout d'une douzaine de jours. Le bactériophage a alors utilisé un autre récepteur membranaire de la bactérie, nommé OmpF. Aucun article de la littérature scientifique n'avait montré que lambda pouvait se lier à cette protéine membranaire. Cette nouvelle spécificité ne le rend pas pour autant inapte à réutiliser LamB s'il était confronté à une Escherichia coli qui l'exprimait. Il a juste acquis une fonction supplémentaire.
En analysant le patrimoine génétiquegénétique du bactériophage, les chercheurs se sont aperçus que tous ces parasitesparasites n'avaient subi que 4 mutations, et qu'elles concernaient la protéine J, lui conférant le pouvoir de se lier à OmpF et de redevenir infectieux.

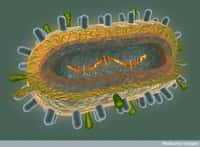
Le récepteur OmpF représenté en 3D. Ce récepteur présent à la surface de la membrane d'Escherichia coli n'est habituellement pas la cible du bactériophage lambda. Mais le virus a su évoluer et s'en servir pour infester son hôte. © MSU
Coévolution : la course aux armements
Quant aux 75 % de colonies résistantes, elles ont développé une parade. Les bactéries survivantes présentaient une mutation au niveau d'une protéine canal de la membrane interne, qui empêchait le génome du virus d'intégrer le cytosolcytosol et donc de devenir infectieux. Dans ce cas de figure, puisque le récepteur OmpF ne devenait pas une cible intéressante, les chercheurs n'ont pas relevé les 4 mutations, la pressionpression sélective les poussant à se focaliser sur d'autres moyens d'entrée.
Justin Meyer, l'un des biologistes impliqués dans l'étude, décrit ces découvertes comme « une danse coévolutive très délicate ». Avant de préciser : « Les bactéries franchissent un palier [en ne présentant plus le récepteur LamB], ce qui crée un nouvel environnement. Le bactériophage est contraint de s'adapter et de développer plusieurs réponses. S'il fournit les quatre nécessaires, alors il peut pénétrer dans son hôte via un nouveau récepteur... Mais si la bactérie évolue avant que le virus n'ait pu s'équiper complètement, alors il abandonne le processus et nous n'observons pas l'émergenceémergence de cette nouvelle capacité. »
Cette coévolution aussi rapide paraissait pourtant improbable. Justin Meyer estime même qu'il y avait 1 chance sur 1.000 milliards de milliards (1021) pour que les 4 mutations se produisent. C'est pourtant arrivé dans un quart des boîtes de cultures.
Certains virologues se félicitent tout de même de ce travail. Ils espèrent un jour être capables de prévoir en avance l'évolution pour mieux nous protéger des infections.