Le soufre influence la quantité de protéinesprotéines, qui interviennent à tous les niveaux dans la cellule, mais aussi la qualité à travers la synthèse des acides aminésacides aminés qu'il contient : cystéinecystéine et méthionineméthionine. Ces acides aminés soufrés sont groupés en plusieurs familles aux propriétés différentes selon leur groupe latéral.

Les acides aminés sont groupés en plusieurs familles, par exemple :
- aliphatiques : le radical est une chaîne hydrogéno-carbonée apolaire ;
- hydroxylés avec un groupe alcool donc polaires, mais non chargés et neutres.
- soufrés avec un soufre dans la chaîne latérale. L'un d'eux, la cystéine est un thiol, deux cystéines peuvent établir une liaison covalente entre leurs atomes de soufre respectifs.
- dicarboxyliques avec un groupement acide à l'extrémité de leur chaîne latérale, donc polaires, chargés négativement (à pH neutre) et acides.
- aromatiquesaromatiques avec un cycle aromatique dans la chaîne laterale, non chargés et fortement apolaires
- etc.
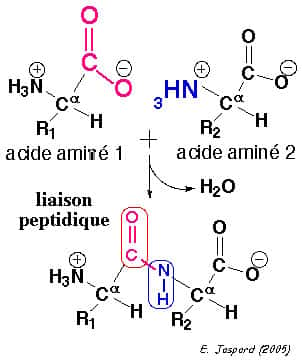
La liaison peptidique
Le groupement acide peut réagir avec le groupement amine d'un autre, avec élimination d'une molécule d'eau pour former une liaison covalente nommée liaison peptidique. La molécule est un dipeptide. D'autres acides aminés peuvent réagir avec lui et former un polypeptidepolypeptide. La propriété de la liaison peptidique est qu'elle est mobilemobile autour de son axe et ceci confère aux protéines des propriétés particulières et « vitales ».
Les protéines
Une protéine est constituée de peptidespeptides, les plus courtes avec une cinquantaine d'acides aminés, les plus longues avec plusieurs milliers. Elles peuvent porter une chaîne glucidique, on a alors des glycoprotéinesglycoprotéines ou former des agrégats divers dont les hèmeshèmes, par exemple, associés à un atomeatome de métalmétal comme l'hémoglobine ou la chlorophyllechlorophylle. Les protéines interviennent à tous les niveaux dans la cellule.
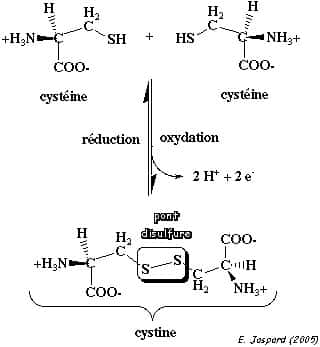
Le pont disulfure
La cystéine est l'acide L-2-amino-3-mercaptopropionique. Sa chaîne latérale porteporte un groupement sulfhydryle (-SH) extrêmement réactifréactif. L'autre acide aminé sulfuré, la méthionine, porte un groupe méthyle, est plus hydrophobehydrophobe, d'un encombrement plus important et moins réactive. Deux cystéines reliées par un pont disulfure donne une cystine, le troisième acide aminé sulfuré. Un pont disulfure est une liaison covalente entre 2 atomes de soufre de la chaîne latérale de 2 résidus cystéines (Cys) réduits. Ils sont formés dans un milieu cellulaire oxydant.
Le cytoplasmecytoplasme n'est pas oxydant, il y a donc peu de protéines intracellulaires qui possèdent des ponts disulfure (seulement 27 %). Un pont disulfure peut être établi entre deux cystéines d'une même chaîne polypeptidique ou de deux chaînes polypeptidiques différentes. Le nombre de ponts disulfure des protéines varie : les toxines, pourtant de très petites protéines (20 à 30 acides aminés) peuvent en contenir jusqu'à 6 ! Toutes les cystéines ne forment pas un pont disulfure.
L'énergieénergie libre de liaison est importante et contribue à la stabilisation de la structure tridimentionnelle de la protéine, sans forcément jouer un rôle déterminant dans le repliement des protéines. La formation d'un pont disulfure est une réaction d'oxydo-réduction réversibleréversible qui dépend du potentiel rédoxrédox et du pH. Il semble que les bactériesbactéries hyperthermophiles augmentent le nombre de ponts disulfure de leurs protéines pour qu'elles résistent mieux à la chaleurchaleur.