au sommaire
Connu depuis l'Antiquité, le soufre possède des formes allotropiquesallotropiques aussi bien à l'état solideétat solide que liquide ou gazeux. Il est extrait des gisementsgisements où il est à l'état natif, des sulfures minérauxminéraux appelés pyritespyrites, des gaz naturelsgaz naturels ou encore des pétroles bruts et des mines de charboncharbon.

Il est connu depuis l'Antiquité. Le soufre, çulbâri : ennemi du cuivre en sanskrit ; sulphur, sulfur ou sulpur en latin.

L'Encyclopédie, ou Dictionnaire raisonné des sciences des arts et des métiers, Denis Diderot et Jean le Rond d'AlembertJean le Rond d'Alembert, le décrit comme : « Soufre, s. m. (Hist. nat. Minéralogie & ChimieChimie.) sulphur ; c'est une substance solide, mais friable, d'un jaune clair lorsqu'il est pur, très inflammable, et qui en se brûlant répand une flamme bleuâtre accompagnée d'une odeur pénétrante et suffocante. Il se fond très aisément lorsque le feufeu ne lui est point immédiatement appliqué, et pour lors il ne s'enflamme point.
La nature nous présente le soufre de deux manières : ou il est pur et sous la forme qui lui est propre, ou il est combiné avec d'autres substances du règne minéralminéral, qui par leur union avec lui le rendent méconnoissable ; c'est ainsi qu'il est dans les mines où il est combiné avec les métauxmétaux.
Le soufre pur que l'on nomme aussi soufre fossilefossile, soufre natif, ou soufre vierge, se trouve abondamment dans quelques endroits de la terre ; ce n'est que dans le voisinage des volcansvolcans et des endroits sujets aux embrasememens souterreins que ce soufre se rencontre ; et partout où on le voit, on doit supposer qu'il a été produit & sublimé par les feux de la terre ; ils l'ont dégagé des substances avec lesquelles il étoit combiné ; ils l'ont sublimé comme auroit pû faire un fourneau, et ils l'ont porté à la surface de la terre. »

Nom, Symbole, Numéro Soufre, S, 16 non-métal
- Masse volumiqueMasse volumique : 1.960 kgkg/m3
- CouleurCouleur : jaune
- Masse atomique : 32,065 u
- Rayon atomique : 100 pm
- Rayon de covalence : 102 pm
- Rayon de van der Waals: 180 pm
- Configuration électroniqueConfiguration électronique : [Ne] 3s2 3p4
- État(s) d'oxydationoxydation : ±2, 4, 6
- Structure cristalline : orthorhombique
- Température de fusionfusion : 388,36 K
- Température de vaporisationvaporisation : 717,87 K
- Électronégativité : (Pauling) 2,58
- ChaleurChaleur massique : 710 J/(kg•K)
- 1er potentiel d'ionisationionisation 999,6 kJ/mol
- 2e potentiel d'ionisation 2.252 kJ/mol
- 3e potentiel d'ionisation 3.357 kJ/mol
- 4e potentiel d'ionisation 4.556 kJ/mol
- 5e potentiel d'ionisation 7.004,3 kJ/mol
- 6e potentiel d'ionisation 8.495,8 kJ/mol
Isotopes les plus stables
32S 95,02 % stable avec 16 neutronsneutrons - 33S 0,75 % stable - 34S 4,21 % stable - 36S 0,02 % stable plus un isotopeisotope radioactif très peu courant.

Minerais et préparation
État natif : dans les terrains volcaniques et certaines terres sédimentaires (Louisiane, Texas).
Sulfures :
- H2S (gaz de Lacq, 4000 tonnes par jour) ;
- FeS2 pyrite ;
- ZnS blendeblende ;
- PbS galène ;
- sulfates anhydrite ou gypsegypse CaSO4.
Procédé Frash au Texas : on injecte de la vapeur d'eau à 160 °C dans le gisement, ce qui le fait fondre, puis de l'airair comprimé est injecté dans le puits pour faire remonter le soufre fondu à la surface.
Procédé employé à Lacq : H2S est brûlé en SO2 qui réagit avec H2S pour donner du soufre : SO2 + H2S -> 3 S + H2O
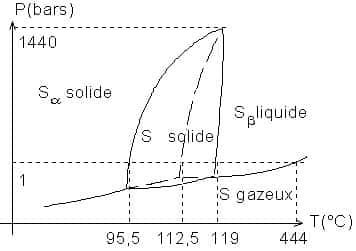
Variétés allotropiques
- Octaèdrique, rhomboèdrique : sa masse volumique vaut 2060 kg.m-3.
- Cinorhombique, en aiguilles : sa masse volumique vaut 1960 kg.m-3.
L'équilibre est athermique ; son enthalpieenthalpie vaut 0,38 kJ/mol. C'est un équilibre monovariant.
Par chauffage lent, la transition se fait à 95,5 °C sous 1 barbar. Mais la transformation est lente, et, si l'on élève rapidement la température, le soufre n'a pas le temps de se transformer et fond à 112,8 °C sous 1 bar.

À 119 °C, le soufre est un liquide jaune mobilemobile. Sa viscositéviscosité va diminuer si l'on chauffe à 155 °C. C'est le soufre formé de moléculesmolécules S8 cycliques. Si la température dépasse 160 °C, le liquide devient visqueux et noircit. Le maximum de viscosité est à 190 °C : c'est le soufre formé de chaînes obtenues par rupture des cycles S8. Les chaînes se disloquent ensuite, on obtient un liquide brun, vers 400 °C, formé de molécules S2 paramagnétiquesparamagnétiques, et encore de quelques molécules S8 ,S6 et S4. À 1.700 °C, il ne reste dans le gaz que des molécules S2.