au sommaire
- Les éléments natifs
- L'or et l'écorce terrestre
- Principaux minerais d'or
- Propriétés atomiques
- Propriétés physiques
- L'or est diamagnétique
- L'or pur est inaltérable
- Comment expliquer cette caractéristique ?
- De l'expérience de Rutherford à la structure de l'atome
- Conclusions
- Propriétés chimiques de l'or
- Action des acides sur l'or
- Action catalytique de l'or
- Composés avec le chlore
- Composés avec le soufre
- Composés avec le cyanure
- À lire aussi
Éclatant comme le Soleil, l'or pur est un métal inaltérable. Est-ce cela qui le rend si prisé, plus que sa rareté ?

Les éléments natifs
Les éléments du tableau ne contiennent qu'un groupe peu nombreux de minérauxminéraux, et on ne les trouve que rarement à l'état natif. Sur les 103 éléments chimiques actuellement connus, il n'en existe que 22 sous forme de minéraux. On y distingue deux catégories.
Les métauxmétaux
- L'argent / silver (Ag Cubique, D = 10 - 11)
- Le cuivre / Copper (Cu Cubique, D = 8.9)
- Le fer / Iron-nickelnickel (rare) (Fe Cubique, D = 7.3 - 7.8)
- Le mercuremercure et les amalgamesamalgames / Mercury (Hg Hexagonal, D = 13.6)
- L'or / Gold (Au Cubique, D = 19.3)
- Le platineplatine / Platinium (Pt Cubique, D = 21.5)
- Le plombplomb / Lead (rare) (Pb Cubique, D = 8.9)
Les non métaux
- L'antimoineantimoine / Antimony (Sb Hexagonal, D = 6.6 - 6.7)
- L'arsenicarsenic / Arsenic (rare) (As Hexagonal, D = 5.7)
- Le diamantdiamant / Diamond (C Cubique, D = 3.52)
- Le graphitegraphite / Graphite (C Hexagonal, D = 2.1 - 2.3)
- Le soufresoufre / Sulfur (S Orthorhombique, D = 2)
L'or et l'écorce terrestre
L'or est, par importance de quantité, le 75e élément constituant l'écorce terrestre. Cette dernière en contient 4.10-7 % jusqu'à une profondeur de 16 kilomètres. L'eau de mer en contient un peu, quelques milligrammes par tonne sous forme soit de particules fixées, soit sous forme d'ionsions AuCl4-.

Symbole Au
Système : cubique
Densité : d : 15,5 - 19,3
DuretéDureté : 2,7
Propriétés : peu dur, très lourd, ductile, malléable
ClivageClivage : non
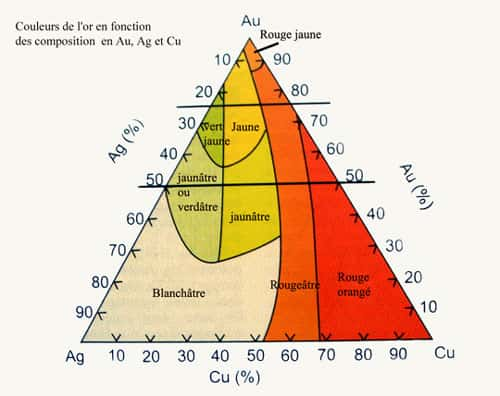
CouleurCouleur : jaune ou rouge ou blanc même vert...
Éclat : métallique vif
TransparenceTransparence : opaque
Très facilement associé à Ag mais aussi à Cu...
Métal et minéralminéral rarement en cristaux nets (octaèdres). En agrégats maclés, en lamelles, réticulé, dendritique, en arborescence, filiformefiliforme.
Principaux minerais d'or
- Calavérite (Au, Ag) Te2 avec une teneur théorique de 43,59 % d'or, monoclinique.
- Krennerite a la même formule mais pas le même système cristallinsystème cristallin, rhombique.

- Nagyagite Pb13Au2Sb3Te6S16 avec une teneur de 8,33 %, système rhombique.
- Petzite Ag3AuTe2 ou (Ag,Au)2 Te, teneur de 25 % environ, système cubiquesystème cubique.

- Hessite, Ag2Te minéral souvent associé à de grandes quantités d'or.
- Sylvanite AgAuTe4 ou Te2, teneur d'environ 25 %, système monocliniquesystème monoclinique.

Les pépites des placers, or métallique, sont cristallisées dans le système cubique faces centrées (la plus grosse pépite connue qui pèse 350 kgkg se nomme Bill End et vient de Nouvelle-Galles du Sud en Australie).
L'or coexiste très souvent avec l'argent (électrum, alliagealliage naturel) dans les mineraisminerais, leur rayons ioniques sont voisins, de même avec le cuivre (sous forme d'auricuivrure, porpezite), plus rarement avec le fer, le mercure, le platine, le bismuthbismuth ou l'uraniumuranium... Certains minéraux sont souvent associés à l'or : sulfuressulfures, quartzquartz, arsénopyrite, cobaltite, pyritepyrite, stibine...
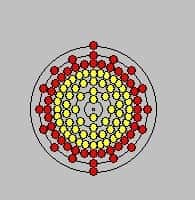
Propriétés atomiques
Numéro atomiqueNuméro atomique : Z = 79
MasseMasse atomique : 196.96655 u
Rayon atomique : 135 pm
Rayon de covalence : 144 pm
Rayon de van der Waals: 166 pm
Configuration électroniqueConfiguration électronique : Xe 4f14 5d10 6s1, c'est le premier élément du tableau à posséder cinq couches électroniquescouches électroniques saturées.
États d'oxydationoxydation (oxyde) 3, 1 amphotèreamphotère
IsotopesIsotopes : 197Au est stable avec 118 neutronsneutrons, à l'état naturel. Il semble qu'il existe un isotope radioactif de même masse, son rayonnement très faible et mal défini pourrait avoir une influence sur la croissance des plantes.
196Au avec TT1/2 = 5,6 jours
198Au avec T1/ 2 = 2,7 jours
199Au avec T1/2 = 3,15 jours.
Propriétés physiques
État de la matièreÉtat de la matière solidesolide
Température de fusionfusion : 1337.33 K
Température de vaporisationvaporisation : 3129 K
VolumeVolume molairemolaire : 10.21 ×10-6 m3/mol
ÉnergieÉnergie de vaporisation : 334.4 kJ/mol
Énergie de fusion : 12.55 kJ/mol
PressionPression de la vapeur : 0.000237 Pa à 1337 K
VélocitéVélocité du son : 1740 m/s à 293.15 K
Les propriétés mécaniques varient selon les impuretés résiduelles et les traitements que l'or a subi avant le test mais la ductilitéductilité, la malléabilité, l'adhésivité des feuilles d'or sont des propriétés très remarquables de l'or. Citons pour exemple qu'avec un gramme d'or on peut faire un fil de deux kilomètres ! Et qu'on réalise des films d'or d'épaisseur inférieure à 10-5 mm. Avec 30 g, on peut faire une feuille de 30 m2, ceci à titre indicatif, juste pour fixer les idées ! Il en va de même des propriétés thermiques, optiques et électriques.
L'or est diamagnétique
Électronégativité : 2.54 (Échelle de Pauling)
Capacité calorique spécifique : 128 J/(kg*K)
ConductivitéConductivité électrique : 09.66 106/m ohmohm
RésistivitéRésistivité : 2,04.10-6 ohm.cm à 0°
Conductivité thermiqueConductivité thermique : 317 W/(m*K)
Coefficient de dilatationdilatation linéaire : 14,66.10-6
1er Potentiel d'ionisationionisation : 890 kJ/mol
2e Potentiel d'ionisation : 1980 kJ/mol
Potentiel d'électronégativité : Eo = 1,46 V ou 1,68 V selon les auteurs pour une concentration d'un ion-g d'or monovalent pour 1.000 g d'eau et de 1,38 ou 1,39 pour l'or trivalent.
On peut remarquer quand même :
- que la biréfringencebiréfringence augmente avec la longueur d'ondelongueur d'onde dans les dépôts cathodiques ;
- que l'or en couches minces a une résistance électriquerésistance électrique anormalement élevée ;
- que la résistivité d'un dépôt d'or de deux micromètresmicromètres à 20 degrés est plus grande que celle de l'or compact ;
- que l'or est le métal le plus électronégatif, ce qui lui donne de nombreuses applicationsapplications industrielles. Les bains utilisés sont des chlorures, bromures, cyanures ou ferrocyanures...
L'or pur est inaltérable
C'est vraisemblablement cela qui en fait un métal si prisé, plus que sa rareté. Cela lui a aussi donné une grande charge symbolique, dès sa découverte par l'Homme. Inaltérable, comme les dieux éternels, éclatant comme le Soleil : son nom vient du latin aurum, signifiant aurore. En grec, or se dit chrysos, une statue d'or et d'ivoire est dite chryséléphantine ; de même chrysanthème se traduit par « fleur d'or ». L'or symbolise ainsi le pouvoir et le divin.

Comment expliquer cette caractéristique ?
L'or est un métal noblemétal noble, il est pauvre en électronsélectrons disponibles pour former des liaisons chimiquesliaisons chimiques, dits électrons de valenceélectrons de valence. Il résiste remarquablement à l'action des produits chimiques. Avec l'or, encore plus qu'avec le platine, le palladiumpalladium ou l'argent, car dans son atomeatome, les orbitesorbites sur lesquelles se distribuent les électrons sont fortement serrées. Cette configuration est à l'origine de son fort potentiel d'ionisation, de sa densité et de son éclat jaune. Il ne peut donc pas se combiner avec l'oxygène : il ne s'oxyde pas, ni ne se ternit.
De l'expérience de Rutherford à la structure de l'atome
L'or est aussi dans l'histoire à l'origine d'une découverte fondamentale, celle de la structure de l'atome ! Lord Ernest RutherfordErnest Rutherford naquit en 1871, en Nouvelle-Zélande, et fit ses études dans deux universités différentes pour ensuite commencer sa carrière en enseignement de la physiquephysique à l'université McGill à Montréal de 1898 à 1907. Il continua dans ce domaine les douze années qui suivirent, mais dans des universités différentes. C'est en 1919 qu'il fut professeur de physique expérimentale et directeur du laboratoire Cavendish, à l'université Cambridge. En 1920, il occupa également une chaire de professeur, à l'Institution royale de Grande-Bretagne, à Londres.
Rutherford fut l'un des premiers et des plus importants chercheurs dans le domaine nucléaire. En 1896, la radioactivitéradioactivité fut découverte par Henri BecquerelHenri Becquerel. À ce moment, on comprit très vite que les rayonnements émis par l'uranium appartenaient à trois catégories différentes. Rutherford baptisa ces rayons alpha, bêtabêta et gamma, du nom des trois premières lettres de l'alphabet grec. Les rayons gammarayons gamma étaient semblables aux rayons lumineux, à la différence près que leur longueur d'onde était extrêmement courte. Les rayons bêta étaient des flots très rapides d'électrons. Tandis que les rayons alpha présentaient une innovation. Ils étaient des courants de particules bien plus massives que les électrons, soit 7.000 fois plus. Malgré cela, les rayons alpha paraissaient vraiment petits, puisqu'ils pouvaient traverser de fines couches de matière, ce qu'aucun atome ne pouvait exécuter.
C'est pour cela que Rutherford décida de prendre des rayons alpha pour réaliser son expérience. Ernest Rutherford avait pour but de découvrir la structure de l'atome en observant les trajectoires des rayons alpha à travers la matière. Son expérience était tout simplement de bombarder une feuille d'or avec des rayons alpha.
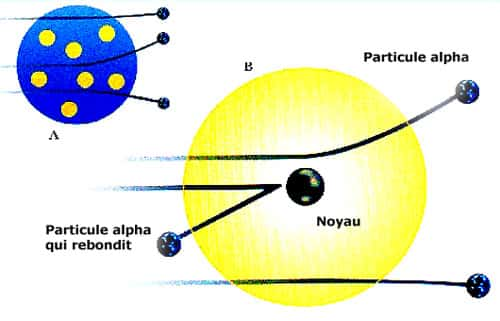
Un écran était placé à l'arrière afin de bien percevoir les résultats. Il pouvait faire cette observation lorsqu'apparaissaient des points brillants qui indiquaient à quel endroit les particules touchaient l'écran. Avec cette expérience, Rutherford s'attendait à une simple petite déviation, mais à sa grande surprise, ce n'est pas du tout cela qu'il a obtenu. Il a obtenu plutôt ceci (voir schéma ci-dessous).
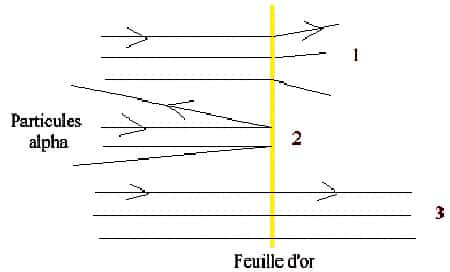
Plus précisément, cela veut dire qu'une très grande majorité des particules alpha traversaient la feuille d'or (3), tandis que d'autres déviaient lors du passage dans la feuille (1) et finalement, une très petite quantité de particules rebondissaient fortement en frappant la feuille d'or (2) d'une épaisseur très minime, soit d'un demi-micromètre. Rutherford fit connaître son interprétation en 1911. Il en tire rapidement une conclusion qui remet en doute l'idée jusque-là admise que les atomes sont des sphères pleines. Une théorie révolutionnaire apparaît alors : l'atome est constitué principalement de vide. La théorie nucléaire de la matière est née. S'ensuit la mise au point d'un nouveau modèle, la théorie du noyau atomique de Rutherford, très vite complété par le modèle imaginé par un physicienphysicien danois du nom de Niels BohrNiels Bohr qui a longtemps travaillé avec Ernest Rutherford.
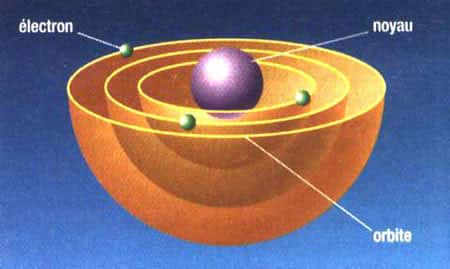
En 1913, Bohr ébauche un modèle qui portera son nom. Les atomes sont faits de noyaux de taille négligeable face à celle de l'atome entier, noyaux qui représentent toutefois la quasi-totalité de la masse de l'atome. Autour de ce noyau se trouve un « cortège » électronique. Les électrons sont situés sur des orbites fixes et se déplacent autour du noyau un peu comme les planètes autour du Soleil. D'où le terme de « modèle planétaire » souvent employé pour définir le modèle de Bohrmodèle de Bohr. Ce modèle a la particularité de permettre l'application de la théorie des quanta d'énergie. Les électrons peuvent « sauter » d'une orbite à une autre par gain ou perte d'un quantum d'énergie.
Conclusions
- L'atome est surtout constitué de vide, puisque la plupart des rayons alpha traversent la feuille d'or, comme s'il n'y avait pas d'obstacle.
- La masse de l'atome est concentrée en un point que Rutherford appela noyau. De plus, la charge de ce noyau est positive, car les particules alpha sont repoussées par le noyau.
- Le noyau est extrêmement petit et dense puisqu'il n'y a qu'une très petite portion des particules qui rebondissent.
- L'atome est neutre, c'est-à-dire qu'il y a autant de charges positives que de charges négatives.
- Les charges négatives, de masse négligeable, quant à elles, gravitent autour du noyau.
Cette théorie relative à la structure atomique et ses travaux en physique nucléaire lui valurent le prix Nobel.
Propriétés chimiques de l'or
On est loin de la transmutationtransmutation du mercure en or chère aux alchimistes du Moyen Âge, même si les chimistes ont essayé toutes sortes d'expériences à ce sujet. Une seule expérience a donné des résultats : des traces d'or y ont été mises en évidence par spectrométrie de massespectrométrie de masse. Il s'agit d'un bombardement de mercure avec des neutrons rapides selon les réactions suivantes :
- 19880 Hg + 10n -> 19879 Au + 11p
- 199 80 Hg + 10n -> 19979 Au + 11p
On le voit bien, rien à voir avec l'alchimie ici ! cette réaction a été obtenue par Sherr et Bainbridge et fut publiée en 1941.
Nous ne traiterons pas ici de l'or colloïdal pour lequel il existe une abondante bibliographie (voir quelques titres de référence en page biblio). Il faut savoir que cet or colloïdal est connu depuis le XVIe siècle... et que c'est le premier hydrosol connu. Il est utilisé en médecine et en biochimiebiochimie entre autres. Il n'y a guère que les halogèneshalogènes comme corps simplescorps simples qui peuvent former des composés avec l'or. La volatilitévolatilité de l'or à haute température dans une atmosphèreatmosphère d'hydrogènehydrogène est cependant attribuée à la formation d'un hydrure.
Action des acides sur l'or
Quelques acidesacides concentrés à chaud entraînent une certaine solubilité non négligeable, par exemple dans le cas de l'acide nitrique concentré bouillant ! Mais l'acide sulfuriqueacide sulfurique et phosphorique sont sans effet en dessous d'une température de 250 degrés ! En revanche une combinaison de deux acides, l'un servant d'oxydant à l'autre, attaque l'or et le dissout : il s'agit de l'eau régaleeau régale un mélange d'acides chlorhydriqueacides chlorhydrique et nitrique...
Action des bases : pas grand chose à signaler
Action des sulfures : pas grand chose non plus
Action des cyanures : voir chapitre sur l'extraction de l'or
Action catalytique de l'or
De très nombreuses réactions sont signalées dans la littérature en chimiechimie minérale :
- synthèse de l'eau entre 130 et 150 degrés en présence d'or réduit ;
- synthèse de l'eau oxygénéeeau oxygénée à partir d'un mélange équimoléculaire d'hydrogène et d'oxygèneoxygène sur un fil d'or chauffé électriquement ;
- oxydation du monoxyde de carbonemonoxyde de carbone par l'oxygène ou le chlorechlore moléculaires ;
- décomposition du protoxyde d'azoteprotoxyde d'azote.
Mais l'or n'est pas un catalyseurcatalyseur d'hydrogénationshydrogénations organiques, sauf pour la transformation de l'acétylène en éthylèneéthylène et pour la réduction (chimie organique) du nitrobenzène en aniline.

Retenons quelques composés de l'or Au+. On a déjà parlé de l'hydrure d'or et des conditions dans lesquelles on peut l'obtenir.
Composés avec le chlore
Il existe plusieurs chlorures. AuCl existe en 3 phases liées par des équilibres chimiques à diverses températures et pressions :
- AuCl3 AuCl + Cl2 et 2 AuCl 2 Au + Cl2 ;
- les aurochlorures existent avec Ag, K,Cs, Na et NH4. On a une formule générale du type 2 M AuCl4 par exemple. Ce sont des sels stabilisés par un excès de chlorures alcalins ;
- le réactifréactif de Grignard AuCOCl, un complexe d'or, permet la préparation de certains hydrocarbureshydrocarbures.
Composés avec le soufre
- les aurothiosulfates avec par exemple, Na3 Au (S2O3)2. 2 H2O ;
- les aurosulfites dans le même ordre d'idée, Na3 Au (SO3)2. 1,5 H2O ;
- les aurosulfocyanures Au (SCNSCN)2- ou Au (SCN)4-.
Composés avec le cyanure
- les aurosulfocyanures Au (SCN)2- ou Au (SCN)4- ;
- les aurocyanures, en fait des sels doubles de Ni par exemple : Ni Au (CN)22 ;
Il en va de même pour Au++, chlorure, bromure et oxyde AuO, obtenu par pyrolysepyrolyse de l'or trivalent hydraté entre 155 et 165 degrés, c'est dire que ce composé est « confidentiel », mais il existe !
De même, les composés avec Au+++ dont certains sont des composés mixtes comme, par exemple, Rb4AuCl42PbCl4.
Toutes ces réactions ne se font qu'en laboratoire et ont pour but de montrer que dans certaines conditions, on peut faire réagir l'or et obtenir des composés de celui-ci. Ceci reste rare et difficile !