au sommaire
La calcitecalcite, l'un des minérauxminéraux les plus communs avec la dolomite représente 22 % des roches sédimentairesroches sédimentaires, c'est-à-dire 237 millions de kilomètres cubes... de roches carbonatéesroches carbonatées !

Pendant très longtemps, la calcite n'était connue que sous son nom de spathspath calcairecalcaire ou de chauxchaux carbonatée. Peut-être est-ce Haidinger qui lui a donné le nom de calcite sous lequel elle est maintenant universellement connue, ce n'est pas tout à fait sûr. Voici quelques-unes de ses propriétés physico-chimiques :
- dureté : 3 ;
- trace : blanche ;
- couleur : incolore, blanche, jaune, brune, rouge, noire ;
- transparencetransparence : transparente, translucidetranslucide ;
- éclat : vitreux, nacré ;
- densité : 2,6 à 2,8 ;
- indice de réfraction : de 1,48 à 1,65 ;
luminescence : blanche, jaunâtre, bleuâtre, rougeâtre, orange, verdâtre ;
- autres propriétés optiques : biréfringence (voir ci-dessous), fluorescence, phosphorescence, thermoluminescencethermoluminescence ;
- composition chimique : 100 % CaCO3 ;
- propriétés chimiques : éclate dans la flamme et libère le CO2, le CaO naissant colore la flamme en orange, bouillonne dans HCl... ;
- nettoyage : à l'eau.
Solubilité de la calcite dans l'eau douceeau douce à 20 °C : 40 à 85 ppmppm et dans l'eau de mer à pH 8,2 : 66 ppm. Pour la dolomiedolomie les valeurs sont respectivement 21 et 50 ppm.
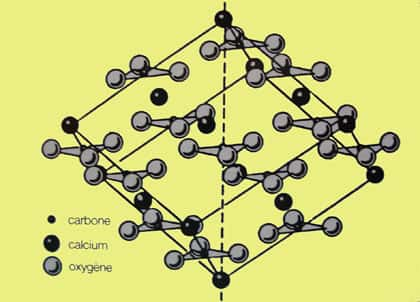
Formes cristallines
Les couches de calciumcalcium alternent avec les groupes carbonates selon l'axe c. Si les groupes carbonates présentent la même orientation dans chaque couche, ils sont opposés dans deux couches successives. Le groupe carbonate constitue la brique élémentaire de constructionconstruction de la calcite, il peut être considéré comme un triangle équilatéral dont le centre est occupé par le carbonecarbone et les sommets par les oxygènesoxygènes. Les atomesatomes d'oxygène sont distants les uns des autres de 0,23 nm et de 0,124 nm de l'atome de carbone. Les liaisons CO sont à considérer comme covalentes, donc très rigides (quatre fois plus fortes que la liaison O-Ca). De cette différence, résulte l'excellent clivageclivage de la calcite qui rompt le minimum de liaisons Ca-O et aucune liaison C-O.
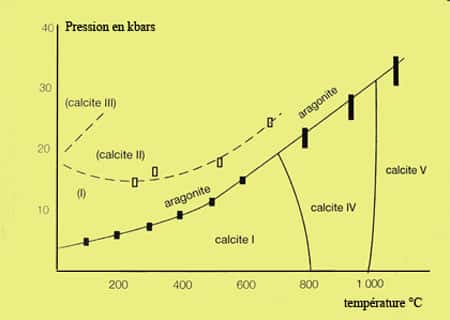
La différence principale avec l'aragonitearagonite réside dans le fait que dans la calcite chaque atome d'oxygène est lié à 2 Ca, alors que dans l'aragonite un arrangement différent lie un oxygène à 3 calcium. L'habitushabitus (la forme normale) du cristal de calcite varie avec la température. Ceci vient du fait qu'il y a plusieurs phases dans le système CaCO3 dans un graphique P,TT (voir ci-dessous).
De même, si on remplace le calcium par du magnésiummagnésium, dans la calcite magnésienne (où il y a moins de Mg que dans la dolomite), la dimension de la maille élémentaire diminue régulièrement en fonction de la quantité de Mg et ce, de manière pratiquement linéaire. Les longueurs de liaison ne sont pas tout à fait les mêmes.
Il existe encore une autre forme de calcite métastablemétastable : la vatérite dans laquelle la coordination du calcium peut être admise comme étant d'ordre 8. C'est une forme hexagonale, très rare à l'état naturel.
Le calcium peut aussi être remplacé, dans la maille élémentaire, par de petites concentrations de MgO de 0,22 à 0,49 % ou de MnO de 0,04 à 4,57 % ou encore de FeO de 0,12 à 5,21 %. Très rares sont les cas dans lesquels le pourcentage est plus important.
Composition de quelques calcites caractéristiques
| Calcite de... | CaO | MgO | FeO | MnO | SrO | BaO | PbO | CO2 | Σ |
| Monterey, Californie | 53,60 | 1,74 | 0,43 | ---- | ---- | ---- | ---- | 44,22 | 99,99 |
| CarbonatiteCarbonatite de Gatineau, Québec | 55,30 | 0,07 | 0,13 | 0,57 | 0,32 | 0,03 | ---- | 44,07 | 100,49 |
| MineraiMinerai Mn, de Langan, Suède | 51,42 | 0,09 | ---- | 2,59 | ---- | ---- | 2,49 | 42,47 | 99,45 |
| Golden Mile, Australie | 53,02 | 0,48 | 2,21 | 0,49 | ---- | 1,18 | ---- | 43,78 | 99,98 |
| Minerai Mn, Groupe Sausar, Inde | 43,88 | 0,41 | ---- | 10,21 | 3,56 | ---- | ---- | 43,88 | 101,53 |
Pseudomorphes de la calcite
La calcite, en raison de sa grande réactivité chimique et de sa solubilité assez forte dans les eaux carbonatées, est fréquemment altérée et/ou remplacée par d'autres espècesespèces minérales. Ce sont des minéraux pseudomorphes de la calcite avec par exemple : l'aragonite, la barytine, la limonite, l'hématitehématite, la pyrolusite, le talc, la silicesilice, etc. Il y en a une trentaine ! D'un autre côté, la calcite peut, elle, remplacer certains minéraux et ce sont parfois les mêmes tels l'aragonite, la barytine mais aussi le gypsegypse, la fluorinefluorine, le soufresoufre, la cérusite, il y en a moins cette fois, disons une quinzaine. Tout ceci dépend des conditions physico-chimiques de l'environnement minéralminéral.

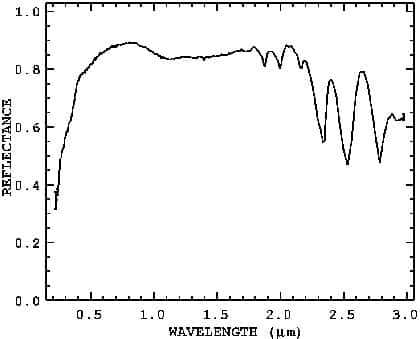
Spectre de la calcite
Le spectrespectre de réflexion que vous avez ci-dessous est obtenu en illuminant un échantillon avec une lumièrelumière blanche définie et en mesurant pour chaque longueur d'ondelongueur d'onde la quantité de lumière réfléchielumière réfléchie par l'échantillon choisi. Les autres photonsphotons sont absorbés par l'échantillon de différentes manières. Ainsi, ces spectres peuvent servir à identifier, par comparaison, la composition d'un échantillon inconnu en nous donnant des informations sur sa composition chimique.
La biréfringence du spath d'Islande (calcite très pure et transparente)
C'est sur la calcite qu'ont été réalisées le plus d'études sur ce phénomène qui fait maintenant partie de tous les TP de physiquephysique des étudiants en optique. Les schémas, ci-dessous, sont d'ailleurs tirés d'un cours de l'université de Nantes.
C'est la particularité qu'ont certains minéraux de dévier et même diviser en deux le rayon de lumière qui les traverse. Les professionnels expriment numériquement la biréfringence. Ils calculent les deux indices de réfraction du minéral, font une soustraction et la différence entre les deux donne la valeur de la biréfringence.

Un minéral qui n'a qu'un indice de réfraction est forcément monoréfringent : en effet on ne peut pas faire la soustraction puisque nous n'avons qu'un seul nombre.
On attribue généralement au Danois Erasmus Bartholinus la découverte de la biréfringence du spath d'Islande. Ses expériences sont décrites dans un ouvrage intitulé : « Experimenta crystalli Islandici » écrit en 1670. En 1690, le physicienphysicien hollandais Christiaan Huygens suppose que pour l'une des images observées à travers le cristal, les rayons suivent un trajet ordinaire (IJo), voir ci-dessous, obéissant aux lois normales de la réfraction avec des surfaces d'onde sphériques. Pour la seconde image, le trajet extraordinaire des rayons (IJe) n'obéit pas aux lois normales de la réfraction et il propose d'utiliser des ellipsoïdes comme surfaces d'onde. Il découvre également que la double réfraction disparaît lorsque les rayons réfractés dans le plan de section principale sont parallèles à la diagonale AA', qui sera la direction de l'axe optique du cristal. Sa méthode est encore en usage actuellement.
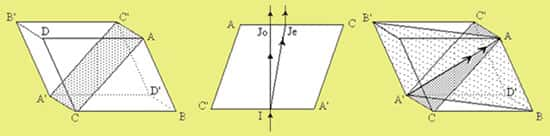
Le plan ACA'C', en pointillé sur le schéma de gauche est normal aux faces ABCD et A'B'C'D' dans lequel les images ordinaires et extraordinaires du trait semblent se superposer, sera le plan de section principale. Le cristal que nous utilisons est un rhomboèdre régulier.
Sur la figure du milieu (plan de section principale), comme dans tout plan parallèle à celui-ci, un rayon incident normal à la face d'entrée se divise en deux rayons dont l'un suit un trajet ordinaire IJo et l'autre un trajet extraordinaire IJe.
Le schéma de droite montre les trois plans de section principaux qui ont pour intersection la diagonale AA', qui sera par la suite la direction de l'axe optique.
Calcite-dolomite-magnésite
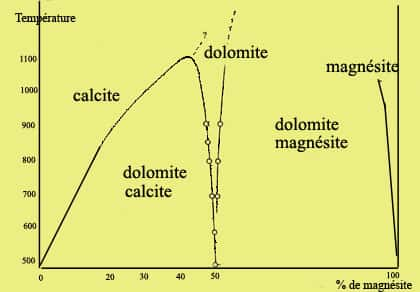
La structure des minéraux de la dolomite est semblable à celle de la calcite mais le diamètre des atomes de calcium et de magnésium est différent de 33 % environ, ce qui oblige le cristal à être très ordonné. Dans la dolomite, en effet, on trouve une couche d'ionsions Ca et une couche d'ions Mg alternativement entre les couches de carbonates, ce qui signifie que le rapport Ca/Mg est de 1. Mais il faut atteindre des températures très élevées, de plus de 1.000 degrés, pour avoir une solution solidesolution solide calcite-dolomite, ce n'est en revanche jamais le cas entre la dolomite et la magnésite. Voici donc le diagramme du système calcite-dolomite-magnésite.
Les isotopes dans la calcite et les paléoclimats
Il y a équilibre chimique quand deux réactions se déroulent en sens inverse à la même vitesse. Dans le cas particulier des équilibres isotopiques, il y a partitionpartition des isotopesisotopes d'un même élément entre deux composés ou deux phases ayant des rapports isotopiques différents.
Les modifications de composition isotopique du carbone peuvent être mises en évidence par la mesure du rapport 13C/12C. Le carbone 13 est un isotope stable dont la concentration est mesurable avec beaucoup de précision par spectrométrie de massespectrométrie de masse. Ces mesures isotopiques s'expriment en termes de différence, δ 13C, entre le rapport 13C/12C de l'échantillon et le rapport 13C/12C d'un carbone standard. Elle est exprimée par rapport à un étalon de référence (Belemnite de la Peedee formation PDB, États-Unis) sous forme de δ 13CPDB.
Par définition le δ 13C de référence (PDB) est égal à 0 pour mille.
(éch = échantillon ; std = standard)
δ13C = 13C/12C éch - 13C/12C std : 13C/12C std
pour exprimer cette variation en ‰, on multiplie le résultat par mille.
L'âge radiométrique prend alors la valeur :
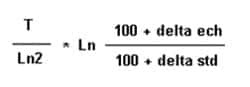
Au cours des équilibres physico-chimiques, des réactions géochimiques et biologiques, auxquels il participe, le carbone subit un fractionnement isotopique dont l'amplitude peut atteindre 3 % pour le 13C.
Le Pr. Graig (1954) ayant montré que l'effet isotopique affectant le 14C est le double de celui du 13C, il est donc possible de tenir compte de ce fractionnement. Mais le CO2 n'est pas toujours en équilibre entre l'eau et l'atmosphèreatmosphère, et la température intervient aussi. C'est le cas quand il y a de la photosynthèsephotosynthèse dans la couche d'eau superficielle. Dans l'eau de mer, les conditions de pH sont telles que la moléculemolécule HCO3- est dominante. Il faut donc modifier un peu ce calcul.
Le δ 13C de la calcite, un indicateur de l'activité biologique des océans. Dans l'océan, comme dans les lacs pendant la période de forte productivité primaire, le profil de δ 13C du DIC (carbone inorganique dissous) avec la profondeur reflète cette répartition : le δ 13C en surface augmente à cause de la photosynthèse, puis il décroît dans la zone d'oxydationzone d'oxydation de la matièrematière organique par apport de 12C, avant de trouver une valeur d'équilibre en profondeur. Ce gradientgradient de δ 13C du DIC est un témoin du fonctionnement biologique de l'écosystèmeécosystème océan.
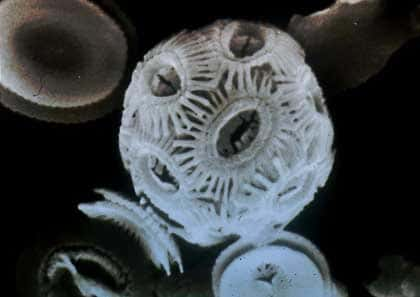
La calcite des tests de foraminifèresforaminifères, un enregistreur du gradient de δ 13C du DIC (voir aussi le calcaire et la vie, à propos des foraminifères). Les foraminifères sont des unicellulaires marins qui vivent soit dans les eaux de surface soit dans les eaux du fond. Ils possèdent un test en calcite qui sédimente après la mort de l'animal et est fossilisé. La calcite des tests a précipité en équilibre avec l'eau de mer, son δ 13C reflète donc le δ 13C du milieu de l'époque. La comparaison du δ 13C des tests de foraminifères planctoniques et benthiquesbenthiques fournit une estimation du gradient de δ 13C entre la surface et le fond. On a ainsi utilisé ce type de résultats pour travailler sur les grandes extinctionsextinctions de l'histoire de la vie et pour essayer d'interpréter ces évènements.
On obtient des renseignements intéressants, par exemple pour l'extinction K/T, extinction CrétacéCrétacé-Tertiaire :
- un ordre de grandeurordre de grandeur de la rapiditérapidité d'extinction : 50.000 ans.
- extinction globale des organismes photosynthétiseurs de la couche superficielle des océans, donc arrêt de production de matière organique, et la permanence de la crise sur 400.000 ans.
- retour très progressif à des conditions favorables à la vie, dans un état différent de l'état antérieur à la crise, ce que l'on peut voir dans le changement du δ13C des eaux de surface.
La dureté de l'eau et la précipitation du calcaire
Le terme dureté est utilisé, lorsqu'il s'agit de caractériser l'eau, dans un sens inhabituel puisqu'une eau dure est simplement une eau qu'on a du mal à faire mousser. Ceci est dû à la présence de sels tels que le carbonate de calciumcarbonate de calcium ou de magnésium. Un des rôles essentiels de la consommation domestique en eau (outre d'être potable) est de se laver et de nettoyer le linge, la vaisselle, etc. De plus, une eau dure entartre plus rapidement les tuyaux et les appareils domestiques, ce qui entraîne des coûts supplémentaires.
La dureté est directement mesurée par la concentration en carbonate de calcium.
Un degré français vaut 10 milligrammes par litre (mg/l) de carbonate de calcium. L'eau est dite douce jusqu'à 18 °f. En dessous de 12 °f, elle risque de faire trop de moussemousse ou d'être trop pauvre en sels minéraux pour être consommable. Entre 18 et 30 °f, l'eau est mi-douce. Au-dessus de 30 °f, l'eau est dure. Au-delà de 50 °f, elle est réputée impropre à la consommation.
L'eau de pluie est naturellement douce voire trop douce. Au contraire, l'eau issue de terrains calcaires tend naturellement à être dure.
Si des eaux calcaires arrivent en surface dans un endroit chaud et sec, elles s'évaporent et la saturation finit par provoquer la précipitation du calcaire. On peut voir ceci à grande échelle dans le parc national d'Etosha en Namibie où tout le bord sud du pan (lac asséché une partie de l'année, voire plusieurs années consécutives) est entouré de « calcrete », ce calcaire évaporitique très blanc.

Concentration de calcite dans les océans
La solubilité varie en fonction de la température, du pH, de la profondeur (de la pressionpression donc). Ne pas oublier que l'équilibre ici fait intervenir un gazgaz, le CO2. Bien qu'il y ait beaucoup plus de magnésium que de calcium dans l'eau de mer, les organismes préfèrent tous les ions calcium. Nous aussi d'ailleurs, une eau trop magnésienne est amère et laxative !
Chaque année, des milliards de petites plantes unicellulaires appelées coccolithophores larguent leur coccolithes au fond de l'océan lors de leur mort, ainsi plus d'un million et demi de tonnes de poussière de calcite se répand dans l'océan, c'est la source la plus importante de la planète. On peut observer cela par satellite, chaque mois, et un spectroradiomètre peut nous en donner une image sous forme de planisphère avec les concentrations de calcite de 0,1 à 20 mg de carbone par mètre cube d'eau de mer.
Les coccolithophores sont près de la surface et font de la photosynthèse : ils absorbent donc les UVUV et reflètent les verts, ce qui donne des reflets verts à l'océan quand ils sont nombreux... alors que leurs tests sont blancs et reflètent toutes les longueurs d'onde. S'ils sont très abondants (on appelle cela une floraison, en biologie), ils forment donc beaucoup de calcite en surface et ceci peut avoir une influence sur l'atmosphère, à travers l'équilibre du CO2 dissous dans l'eau ou gazeux dans l'airair.
Chaque fois qu'une molécule de calcite est formée, une molécule de CO2 est prélevée dans l'eau, une molécule de l'air peut s'y dissoudre : ceci pourrait aider à diminuer l'effet de serreeffet de serre mais on ne connaît pas du tout les effets à terme de cette réaction, d'autant plus que le CO2 peut revenir dans l'atmosphère lors de la dissolution du calcaire avec la profondeur qui déplace l'équilibre dans l'autre sens, ou une modification de la température de l'eau. Les choses sont donc assez compliquées mais plusieurs scientifiques pensent que le bilan pourrait être positif... à voir donc, quand nous aurons plus d'informations sur le sujet !
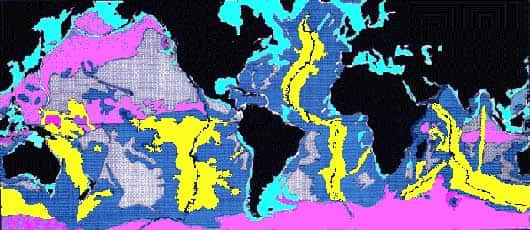
- Rose (antarctiqueantarctique) : boues siliceuses (radiolairesradiolaires).
- Jaune : vases calcaires (> 60 % biogènes).
- Bleu foncé : vases marneuses = mélange argileargile + calcite (
- Gris (pacifique, au large) : argiles pélagiquespélagiques, argiles rouges, sédimentssédiments métallifères (nodules de manganèsemanganèse),
- Bleu clair (autour des continents) : carbonates de plateforme, localement deltasdeltas détritiques (limonslimons et argiles).
Le karst ou la dissolution du calcaire par la pluie (acide)
De karst, nom allemand de la région des plateaux calcaires de Slovénie, dont le nom slave est Kras. L'adjectif karstique est attesté en 1896 (de Lapparent).
Définition : région de formation calcaire caractérisée par la prédominance du drainagedrainage souterrain et par le développement d'une topographie originale due à la corrosioncorrosion de la roche (grottes, gouffresgouffres, résurgences...). Plusieurs concepts importants sont associés au karst. Il faut retenir ceux de phénomène karstique, de système karstique, d'aquifèreaquifère karstique et de réseau karstiqueréseau karstique, pour lesquels des définitions peu précises, variant selon les auteurs, peuvent avoir cours.
L'expression « réseau karstique » désigne parfois le réseau de conduits, ou réseau de drainage d'un système karstique. Mais elle est aussi utilisée parfois dans la littérature spéléologique pour désigner le réseau spéléologique des conduits naturels interconnectés, parcourus ou non par de l'eau, reconnus par exploration. Un réseau spéléologique est le plus souvent constitué par un ensemble de conduits qui se sont formés lors de phases de karstification successives dans un massif.
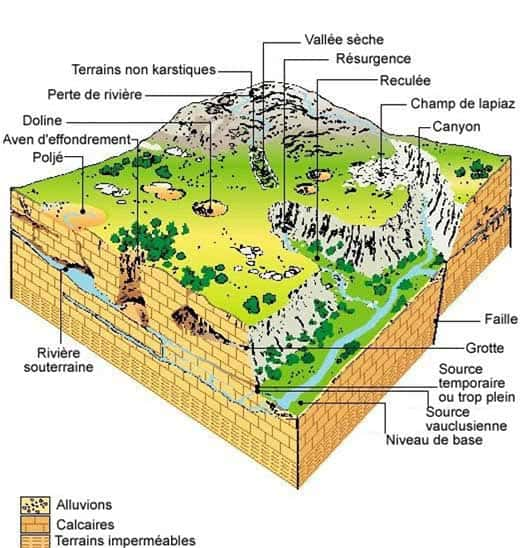
Dans ces roches, la dissolution et l'écoulement souterrain créent des conduits organisés en réseau hiérarchisé de l'amont (les points d'infiltration d'eau dans la roche) vers l'aval (la source). En dehors du réseau karstique, les vides dans la roche sont constitués par des cavités et par les discontinuités de la roche (fissures, fractures et plans de stratificationstratification plus ou moins élargis par la dissolution) ; tous ces vides sont mal connectés hydrauliquement aux conduits. Cette organisation se fait à la manière de celle des fleuves et des rivières, en fonction de la pente générale et de la résistancerésistance opposée par la roche (perméabilité) ; elle peut être plus ou moins linéaire et simple, ou très complexe.
Dans quelles conditions se forme un karst ?
Le processus de mise en place du karst (la karstification) est rapide, en temps géologique évidemment. Pour qu'un réseau se mette en place, il suffit de quelques dizaines de milliers d'années au maximum. Un réseau souterrain se met en place en se « calant » sur le niveau le plus bas des calcaires dans le paysage : c'est le niveau de base, où apparaît la source. Mais les écoulements peuvent se produire à des niveaux inférieurs à celui de la source, en profondeur dans la formation géologique. Ainsi, pour que se forme le karst, il faut que soient réunies les conditions suivantes :
- L'eau doit pouvoir dissoudre la roche, donc contenir un acideacide. L'acide le plus commun résulte de la dissolution du dioxyde de carbonedioxyde de carbone (CO2) produit par la végétation dans les sols.
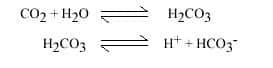
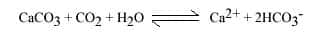
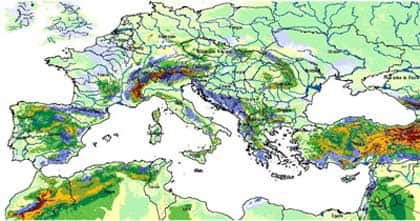
- L'eau doit pouvoir s'écouler à l'intérieur de la roche, c'est-à-dire que l'écoulement souterrain doit se produire, de préférence à l'écoulement superficiel. Comme les vides de la roche (fissures, fractures et joints de bancs) possèdent à l'origine une très faible largeur pour la plupart, la roche présente une faible perméabilité, c'est-à-dire qu'elle oppose une forte résistance à l'écoulement souterrain. Il faut donc qu'existe une charge suffisante d'eau souterraine, soit une hauteur suffisante par rapport au point de sortie. Cette condition est remplie lorsqu'il existe un relief bien marqué, comme en montagne ou dans les régions de plateaux traversés par des gorges (canyons).
Des réactions à vitesses différentes
Les mécanismes sont la dissolution de la roche, l'écoulement souterrain, qui évacue au fur et à mesure les matières dissoutes. La dissolution des roches carbonatées, calcaire et dolomie, est un ensemble de réactions complexes mettant en jeu trois phases : solide, la roche, CaCO3 ou Ca Mg (CO3)2, liquideliquide, l'eau et ses substances en solution, gazeuse, le CO2 produit dans les sols. Il s'agit des réactions se produisant entre l'eau et l'air (dissolution ou évasion du CO2), entre l'eau et la roche (dissociation des minéraux carbonatés) et à l'intérieur de la solution (combinaison des différents ions entre eux).

Comme ces réactions ne sont pas immédiates et se déroulent à des vitesses différentes, la dissolution de la roche se produit soit en surface, soit plus ou moins en profondeur, selon que l'eau circule lentement ou plus ou moins vite. Quand une fissure est élargie par la dissolution, le débitdébit qui la traverse augmente aux dépens des fissures voisines ; elle prend alors de plus en plus d'importance et devient progressivement un conduit. Toutes les fissures voisines cessent de s'élargir, puisque toute l'eau passe par le conduit. Notez qu'en France une partie du Jura, du massif du Vercors, etc. comporte des réseaux karstiques. Notez encore que l'eau de ces réseaux n'a pas été filtrée par les couches géologiques et donc provient directement de la surface, avec tous ses polluants ! Dans un karst, on n'a pas des nappes phréatiques, juste des réservoirs souterrains...