au sommaire
Toutes les roches contiennent de la silicesilice, mais les roches siliceuses en contiennent plus de 60 %. Il existe des relations entre l'eau et les minérauxminéraux du groupe de la silice, liées à la sédimentationsédimentation chimique ou biochimique, à l'altération des roches et à la formation des sols.

Les minéraux silicatés
Les minéraux silicatés représentent environ 95 % de la croûte terrestre d'où leur importance pour le géologuegéologue. Le motif élémentaire de ces minéraux est le tétraèdre de silice sous forme SiO4- lié à des cations K+, Na+, Ca++. Mg++, Fe++ ou Fe+++, Al+++ ou à d'autres siliciums (polymérisation dans ce dernier cas).
Les atomes d'oxygène, plus nombreux et plus gros déterminent la géométrie des silicatessilicates. La liaison Si-O de coordination 4 mesure 1,61 ou 1,62Ǻ dans presque tous les silicates. Le rayon de Si dans le tétraèdre est de 0,39 Ǻ et celui de l'oxygène de 1.32 Ǻ. La liaison chimiqueliaison chimique est donc beaucoup plus petite que la somme des deux rayons (1,71 Ǻ ) soit 1,61 Ǻ, ce qui entraîne une forte polarisation des oxygènes par des ionsions Si fortement chargés.
Dans les aluminosilicates, le rayon du ion Al est de 0,57 Ǻ et le rayon du ion oxygène de 1,32 Ǻ, soit un rapport de 0,43. Ce rapport est assez voisin de 1,41 qui marque la limite où la coordination passe de 4 à 6. Il est donc possible d'avoir un Al tétracoordonné dans les aluminosilicates et c'est bien ce que l'on observe dans les feldspathsfeldspaths par exemple.
Attention, dans les silicates d'aluminesilicates d'alumine où les tétraèdres sont reliés par des atomes d'aluminiumaluminium (ne pas confondre avec aluminosilicates !), l'aluminium est hexacoordonné, par exemple dans le disthènedisthène. De même, dans les micas, l'aluminium est tétracoordonné à certains endroits et hexacoordonné à d'autres, suivant la place qu'il occupe dans le minéralminéral ! Les Anglais ne font pas la différence et tous sont rangés sous le terme « aluminosilicate ».
Voici un tableau très simple des principales familles de silicates.
| Formule | Relation entre les tétraèdres | Schéma | Si/O | Exemples |
| SiO44- | NésosilicatesNésosilicates, tétraèdres isolés liés par un autre atome que Si | --- | 1/4 | OlivineOlivine, Grenats |
| Si2O76- | SorosilicatesSorosilicates 2 tétraèdres liés par un sommet | --- | --- | Mélilite |
| Si6O186- | CyclosilicatesCyclosilicates, tétraèdres en anneaux liés par les oxygènes |  | 1/3 | Béryl, TourmalineTourmaline |
| Si2O64- | InosilicatesInosilicates chaînes simples, tétraèdre lié à 2 autres par les oxygènes |  | 1/3 | PyroxènesPyroxènes |
| Si4O116- | Inosilicates à chaînes doubles liées entre elles par des cations | 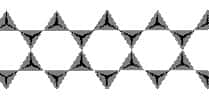 | 4/11 | AmphibolesAmphiboles |
| Si4O104- | PhyllosilicatesPhyllosilicates, tétraèdres en feuilles, chacun lié à 3 autres par sommets communs |  | 2/5 | Kaolinite,ArgilesArgiles, Licaschlorite |
| AlSi3O8- | TectosilicatesTectosilicates, même structure que le quartzquartz mais avec un Al. | --- | 3/8 (¼ feldspa-thoïdes) | Feldspaths |
| SiO2 | Tectosilicates | --- | 1/2 | Quartz |
Prenons deux cas particuliers pour illustrer le groupe des nésosilicates, par exemple :
- Le groupe de l'olivine
L'olivine est une solution solidesolution solide de forstérite Mg2SiO4 et de fayalitefayalite Fe2SiO4. Il faut inclure dans ce groupe la téphroïte Mn2SiO4 et la monticellite CaMgSiO4 et les silicates de Ca qui ont tous la même structure type : γCa2SiO4 la calcio-olivine stable à TT ordinaire, le βCa2SiO4 appelé larnite instable à T ordinaire et enfin le αCa2SiO4, la bredigite qui appartient aux laitiers et peut-être aux ciments Portlandciments Portland.
De nombreux diagrammes d'équilibre ont été étudiés en pétrographie pour interpréter la genèse des roches basiquesroches basiques à savoir les diagrammes binairesdiagrammes binaires : SiO2 - MgO SiO2 - FeO ou ternaires : SiO2 - MgO - FeO ou encore FeO - Al2O3 - SiO2. Dans le diagramme d'équilibre SiO2 - CaO apparaît un silicate tricalcique Ca3SiO5 qui devrait être classé dans les nésosubsilicates et non dans ce groupe mais il est assez connu puisqu'il s'agit de l'alite des ciments Portland.
- Le groupe des zirconszircons
De formule générale XSiO4 ou X 4+ peut être Zr 4+ de diamètre 0,79 Angstroem ou Th 4+ de diamètre 1,02 ou encore U 4+ de diamètre 0,97.
Quadratique, une maille contient quatre moléculesmolécules.
Le zircon, proprement dit ZrSiO4, contient presque toujours du HafniumHafnium -> 6 % dans l'alvite.
La thorite ThSiO4.
L'uranothorite (Th, U) SiO4.
Les zircons des granitesgranites contiennent presque toujours U et Th en remplacement isomorphique de Zr et la détermination des rapports Th/U ou Pb/U sert à déterminer l'âge des granites, ce groupe est donc très important en géologiegéologie.
La thorite et l'uranothorite sont facilement hydratées sans que cela détruise la structure, on a alors la thorogummite (Th, U) (Si, H4)O4 et la coffinite U(Si, H4)O4.
Les roches siliceuses
Toutes les roches contiennent de la silice, mais les roches siliceuses ou acidesacides en contiennent plus de 60 % et c'est d'elles que nous allons parler. Voici, ci-dessous, leur situation sur ce diagramme triangulaire.
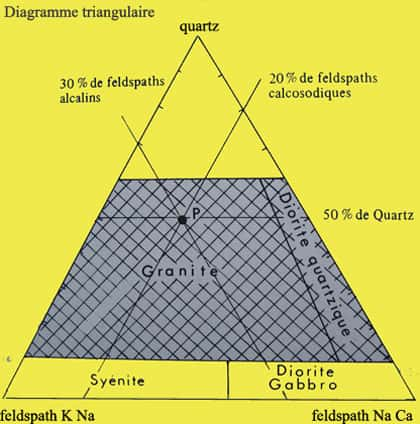
Dans les roches ignéesroches ignées (issues d'un magmamagma), on trouve le granite, intrusif ou plutoniqueplutonique c'est-à-dire qui reste en profondeur, la rhyoliterhyolite, effusive ou volcanique, c'est-à-dire qui s'écoule comme une lavelave acide et très visqueuse.

Les dioritesdiorites quartziques peuvent contenir autant de silice que le granite mais elles contiennent plus de 90 % de feldspaths calcosodiques et sont plus sombres à cause du silicate ferromagnésien (amphibole ou biotitebiotite). La roche effusive de la diorite quartzique est la dacite.
Il existe encore un verre, l'obsidienne, roche volcaniqueroche volcanique refroidie très brusquement et de même composition que le granite.
On trouve des pegmatitespegmatites dans des filonsfilons, roches acidesroches acides à très gros cristaux. Les solutions qui montent dans ces filons le font très lentement et les cristaux ont ainsi le temps de se former et de grandir, c'est précisément dans ce genre de filons que l'on trouve de très beaux cristaux de toutes sortes.

Pour ce qui concerne les roches métamorphiquesroches métamorphiques, ce sont des transformations des précédentes par augmentation de température et/ou de pressionpression : ce sont les gneissgneiss et les micaschistesmicaschistes.
Les roches sédimentaires détritiques proviennent de l'altération des roches précédemment citées. Si l'altération est importante et si le transport est un peu long...On ne retrouvera dans le bassin de réceptionréception que les grains de silice, le sablesable, considéré comme une roche meuble (grains entre 2 et 0,02 mm de diamètre), et les argiles très fines.

Le bassin parisien avec 4,5 millions de tonnes de production de silice en grains produit les 2/3 de la silice française. L'âge de ces sables est soit bartonien soit stampien. Il y a 40 Ma la mer envahit le Bassin Parisien et dépose des sables, d'abord grossiers (sables d'Auvers) puis plus fins (sables de Beauchamp, Ermenonville, Guépelle, Fleurines). Les matériaux proviennent du continent bordier sur lesquels des niveaux plus anciens sont érodés. L'émersion qui suit permet l'installation de paléosols grésifiés qui marquent le sommet de la formation. Ces sables, exploités dans l'Aisne et l'Oise, sont très purs.
Il y a 33 Ma, la mer envahit une dernière fois la région et dépose 60 m de sable dans la région d'Étampes : ce sont les sables de Fontainebleau. Le bassin était très calme, à fond presque plat et les eaux de ruissellement s'y déversent entraînant avec elles des sables fins le long d'immenses chenaux. Le climatclimat était chaud et il s'est sans doute déposé du calcairecalcaire et de l'argile qui ont été ensuite lessivés, ne laissant que le sable de silice très pur, sur le calcaire de Brie, surmonté de bancs de grèsgrès très durs qui constituent l'originalité du paysage de la région. C'est vers la fin de l'époque stampienne que se réalise le début de la grésification quand la mer se retire vers le sud-ouest... mais ceci n'est qu'une étape de la vie du Bassin parisien !
Dès que le sable se compacte on obtient un grès, plus ou moins consolidé au début qui deviendra de plus en plus compact et dur au fil de la diagenèsediagenèse. La silice est un ciment fréquent des grès, croissant en continuité optique sur les grains de quartz et donnant naissance aux quartzitesquartzites si le processus arrive à terme. Suivant l'âge des grès, ce ciment peut être constitué d'opaleopale (forme peu stable de la silice), de calcédoine ou de quartz (forme très stable).
La grésification paraît être un processus assez simple, cependant plusieurs facteurs interviennent nécessairement. Le ciment lui peut être calcaire ou siliceux, le plus souvent siliceux. L'eau remplit l'office d'agent transporteur du ciment entre les grains de sable, que ce soit du calcaire ou de la silice (si cette dernière est colloïdale elle agglutine les grains et accélère le phénomène). La silice utilisée pour former le ciment peut provenir des grains de sable eux-mêmes ou des phytolithesphytolithes formés par les végétaux d'alors mais il faut se souvenir que la grésification ne peut intervenir qu'en milieu humide et dans un sable comportant des fentes (très légèrement indurées par l'humidité au départ) qui permettent la circulation de l'eau. Le problème des ciments siliceux réside surtout dans l'origine de la silice : les eaux marines sont sous-saturées en silice et ne fournissent que peu de matièrematière à la cimentation. De plus, les processus de pression-dissolution ne peuvent être responsables que d'environ 1/3 du volumevolume de ciment. Restent la silice issue de la dissolution des tests des organismes (radiolairesradiolaires, diatoméesdiatomées, éponges) et la silice provenant de la transformation des minéraux argileux. Ce sont deux sources majeures de silice, mais rarement associées géographiquement à des corps sableux importants (argiles, radiolaires, éponges sont plutôt associés à des facièsfaciès profonds). Il faut donc imaginer une circulation diagénétique intense pour expliquer l'existence des ciments siliceux.

Ce grès de l'Hermenault constituait, au nord de Fontenay-le-Comte, en Vendée, une « mine » exploitée pour les meules à grains. On dégageait la meule par une incision circulaire tout autour du bloc. On creusait ensuite à la broche, par percussion, tout autour jusqu'à la hauteur souhaitée pour la meule et on enfonçait des coins métalliques (dans des emboîtures creusées tout autour, elles aussi) pour séparer la meule de son support. Il semble que cette exploitation était très ancienne puisqu'on a retrouvé une petite meule de ce matériaumatériau dans une tombe néolithique mais les grandes meules ont été fabriquées au Moyen Âge et le site approvisionnait une bonne partie de la côte ouest de la France : on ne connaissait pas encore à l'époque les meules par assemblage.

L'exploitation était d'importance, en effet, puisque Louis XI accorda une foire à la ville, signe qui ne trompe pas dans l'histoire du commerce : outre les carriers, il y avait là tous les corps de métiers nécessaires à l'exploitation, les corderies, les forges, les écuries, les auberges, etc. Ce qui, à l'époque représentait pas mal de monde qui devait séjourner sur place. L'abandon de la production dans la seconde moitié du XIXe correspond précisément à la généralisation de l'usage de meules assemblées.
Il y avait beaucoup de difficultés à exploiter un matériau aussi dur avec les outils de l'époque : la barre à mine n'existait pas, on n'était pas capable de faire des barres en ferfer assez dures (il faudra attendre l'acieracier pour ça !). Il fallait sans doute beaucoup de temps et de patience, il est vrai que la main-d'œuvre n'était pas chère... et corvéable à merci...
Sur le plan de la géologie ce grès s'est formé dans l'ancien cours d'un fleuve qui se trouvait au bord de la mer hettangienne au Lias inférieur. Ces anciennes vallées étaient couvertes de végétation, surtout d'équisetites, sorte de fougèresfougères, dont on trouve des troncs fossilesfossiles dans ce grès d'ailleurs. Ces fleuves charriaient du matériel de la chaîne hercyniennechaîne hercynienne, déjà bien érodée, dans une direction grossièrement N-S.

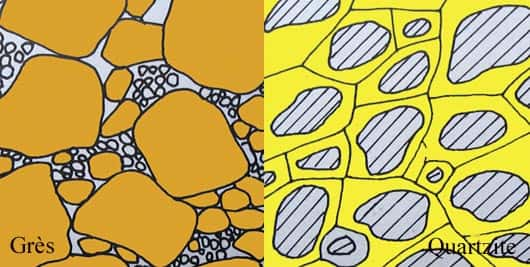
Il faut signaler, encore, ici une roche particulière : le quartzite, roche essentiellement constituée de grains de quartz cimentés par du quartz néoformé. Le grès quartzeux, lui est formé de grains de sable essentiellement siliceux cimentés par un ciment siliceux. En fait, dans un grès on voit encore les grains et dans un quartzite on ne voit presque plus rien ! Le quartzite peut provenir d'un tel grès par diagenèse mais elle peut aussi être la roche métamorphique qui correspond à la recristallisationrecristallisation d'un ancien grès ou d'une ancienne radiolarite ou encore d'un filon de quartz. La différenciation entre quartzite sédimentaire et métamorphique n'est pas toujours facile.
Quelques roches sédimentairesroches sédimentaires se forment directement par processus chimique ou biochimique. Ce cas est représenté par les radiolarites (voir chapitre : la silice et la vie) et le silex (voir chapitre : du cristal de roche au silex).
La silice et l'eau
La silice qui se forme par réaction à partir de solutions à Patm se présente sous forme de gelsgels qui évoluent lentement en se déshydratant vers les phases cristallisées stables.
L'action de l'eau sur la silice à température ordinaire est complexe. On trouve, en solution Si(OH)4 qui se polymérise facilement pour donner des gels et des polymèrespolymères solides. On a reconnu pour l'acide silicique une ionisationionisation en deux étapes :
- Si (OH)4 -> H+ + SiO (OH)3 -, suivi de : SiO (OH)3 -> H+ + SiO2 (OH)2 2-.
Acide plus faible que l'acide carboniqueacide carbonique et d'une stabilité très précaire en solution déjà très diluée. Il existe aussi des acides oligosiliciques dont un au moins est connu par ses estersesters, c'est l'acide disilicique obtenu à partir du précédent par déshydratationdéshydratation :
- (OH)3 Si - O - Si (OH)3 qui pourrait se poursuivre et donner : (OH)3 Si - O - Si(OH)2 -O - Si (OH)3, réaction qui semble réversibleréversible par coupure hydrolysante...
On pourrait continuer mais dès l'obtention de l'acide trisilicique la condensationcondensation déshydratante peut se faire sur un groupe OH du Si central et la molécule cesse alors d'être linéaire. On peut aboutir à des macromoléculesmacromolécules polydimensionnelles et par constructionconstruction d'un réseau, plus ou moins cohérent qui lie les molécules entre elles, on obtient un gel (très hygrophilehygrophile : les silicagels sont bien connus comme déshydratants) dans lequel l'eau interstitielle est saturée en silice amorpheamorphe. On peut chasser l'eau de ces composés par augmentation de pression et on descend ainsi jusqu'à 4 à 6 % d'eau fixée par inclusion, adsorptionadsorption ou liaison H, il faut alors augmenter la température mais même dans le quartz de synthèse ainsi obtenu le spectrespectre Raman indique la présence de quelques groupes OH résiduels.
La silice se comporte avec l'eau comme un anhydrideanhydride et en s'y dissolvant elle donne un liquideliquide légèrement conducteur de pH 4,7 à saturation, c'est-à-dire pour une concentration en ion H+ de 2/100.000 pour une concentration molairemolaire de 215/100.000... On peut donc admettre que le solide réagit avec l'eau ! La solubilité de la silice amorphe dans l'eau est très faible de 0,05 à 0,08 g/l à 0 °C et jusqu'à 0,44 g/l à 100 °C. Elle dépend très peu du pH jusqu'à ce que celui-ci atteigne 9. Mais si le pH dépasse 9 la molécule Si(OH)4 s'ionise et la solubilité augmente alors fortement : elle atteint 4.000 ppmppm à pH 11, par exemple (cas de certains lacs évaporitiques). Mais tout ceci n'est vrai qu'à nature d'ion constante. En effet, la solubilité de la silice n'est pas fonction du seul pH, mais aussi des ions en présence. C'est ainsi que Fe3+ en solutions acides (pH 1,5 à 3) produit une dissociation de la silice bien plus importante que Ca++ ou NH4+ dont les solutions ont des pH faiblement acides, neutres, voire alcalins. Parmi les autres ions, seuls Al+++ et Mg++ affectent la solubilité en l'abaissant. Il se formerait une mince couche protectrice de silicate d'aluminium ou de magnésiummagnésium...
Le quartz est moins soluble que la silice amorphe et pour les poudres la solubilité dépend aussi du diamètre des grains. La solubilité de grains de quartz ou d'opale dont le diamètre est supérieur à 250 μ est toujours pratiquement nulle après 200 jours à 20 °C. Si les grains mesurent 5 μ et ont été débarrassés de la couche amorphe due au concassage et au broyage on obtient une solubilité de 0.007 g/l à 20 °C au maximum mais il faut plus de 200 jours, en tous les cas pour la terre à diatomées et l'opale.
Les conséquences géochimiques de ces résultats importantes
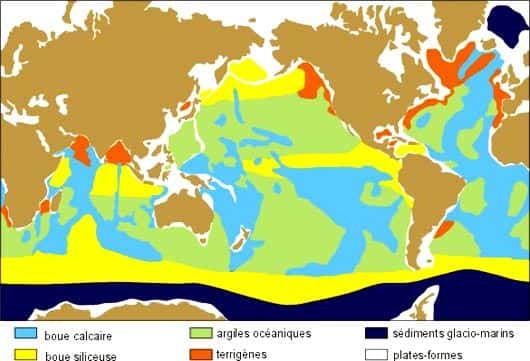
Dans les conditions naturelles le pH ne dépasse jamais 9, la silice est donc en solution sous forme non ionisée et on est en général autour de 0,035 g/l ou moins dans les eaux douces et autour de 0,001 à 0,002 g/l pour l'eau de mer. Cette silice moléculaire en solution réagit avec d'autres composés pour former des silicates de néoformationnéoformation des roches sédimentaires, en particulier ceux des argiles. L'eau de mer est très nettement sous-saturée par rapport à la silice (environ 1 ppm). La silice amenée par les eaux fluviales, fournie par l'altération sous-marine des basaltesbasaltes est immédiatement utilisée par les organismes. En effet, la concentration de la silice dans l'océan varie en fonction de la profondeur : moins de 1 ppm dans la zone photiquezone photique riche en êtres vivants, jusqu'à 11 ppm au-delà de deux kilomètres de profondeur. Enfin, il faut bien noter qu'en matière de stabilité, la silice se dissout si le carbonate précipite et vice versa : ceci explique la disparition très rapide des spicules d'éponges dans les récifs carbonatés.
D'autre part, il faut prendre en considération la température de fusionfusion de la silice en fonction de la pression d'eau environnante.
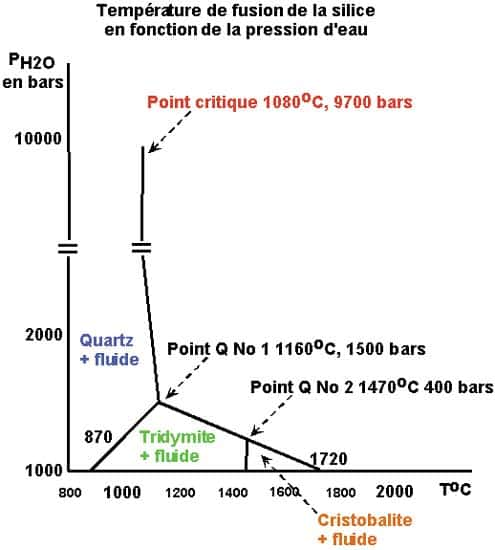
Le point critique (9.700 barsbars, 1.080 °C) du système univariant silice-eau donne une composition pondérale de 75 % poids de SiO2 et 25 % poids d'eau, soit une composition chimique voisine de SiO2H2O environ.
Le point quadruple No 1 (1.500 bars, 1.160 °C) avec quartz, tridymite, silice liquide et gazgaz.
Le point quadruple No 2 (400 bars et 1.140 °C) avec tridymite, cristobalite, silice liquide et gaz.
La teneur en silice de la phase gazeuse augmente avec la pression d'eau :
- 2.000 bars : 1.105 °C -> 5,7 % ;
- 4.000 bars : 1.075 °C -> 10 % ;
- 8.000 bars : 1.049 °C -> 28 % ;
Ces données indiquent une solubilité importante de la silice dans l'eau à des pressions d'eau relativement basses et expliquent, en particulier et par exemple, la genèse des filons de quartz, ou même de certaines roches. En revanche, la pression d'eau (nécessaire à la fusion à ces températures) passe à plus de 10.000 bars pour la coésite et la stishovite.
Le processus de silicification
La silicification est une imprégnationimprégnation (épigénie) par la silice d'une roche préexistante pouvant être liée à des phénomènes magmatiques et hydrothermaux, des migrations de la silice dans certaines roches métamorphiques ou encore à des précipitationsprécipitations de silice dans les roches sédimentaires.
Le plus souvent, la source de silice est le test d'organismes siliceux dissout. La silice circule ensuite dans les roches et précipite dans un autre endroit dans le même sédimentsédiment ou dans un sédiment voisin. La silice peut aussi provenir de roches diverses par dissolution ou encore être liée à des émissionsémissions volcaniques. L'enrichissement de l'eau de mer ou de lac en silice provoque l'augmentation subséquente d'organismes à test siliceux qui participent ensuite à la formation de sédiments. On obtient ainsi un certain nombre de roches : diatomitediatomite, gaize, jaspe, lydienne, meulière, phtanite, radiolarite, silexite, spongolite...
La silice peut aussi provoquer une modification de la composition chimique d'une roche et par exemple remplacer complètement le calcaire dans un dépôt. Cette silicification est une métasomatosemétasomatose, il s'agit d'un métamorphismemétamorphisme dit allochimiqueallochimique ou métasomatiquemétasomatique. Cette épigenèse (remplacement lent d'un minéral par un autre dans une roche) s'effectue molécule à molécule et il y a conservation très précise des formes et des structures de l'élément originel. On peut ainsi avoir un passage de la calcitecalcite à la dolomite (dolomitisation) et de la dolomite à la silice (silicification) ou directement de la calcite à la silice, par exemple dans l'hettangien du littoral : ce calcaire est en contact direct avec le socle duquel est « monté » une solution siliceuse qui a complètement remplacé la calcite dans le dépôt hettangien et la silice a même moulé les cristaux de barytine qui ont disparu et on voit très bien les formes persistantes de ces derniers.

Les phtanites
Haüy a défini ce terme dans les terrains précambriensprécambriens du massif armoricain. D'autres roches semblables se sont développées au SilurienSilurien. Les caractères marquants sont :
- Des roches presque entièrement siliceuses mais ne présentant jamais de quartz détritique.
- La silice est de la silice de néoformation se présentant sous forme de quartz dont les cristaux ne sont pas visibles à l'œilœil nu. Les granules de quartz sont moulés les uns sur les autres et mesurent entre 0,01 et 0,02 mm.
- Ces roches sont en couches continues ou en bandes interstratifiées dans des schistesschistes et des grauwackes, elles sont sans fossiles, sauf quelques radiolaires.
- De couleurcouleur grise ou noire, elles contiennent des matières organiques graphiteuses (jusqu'à 30 %) qui devraient provenir de la décomposition de radiolaires.
Ces roches sont considérées comme étant d'origine marine par la plupart des auteurs.
Pour certains auteurs (par exemple Müller en 1970), toute la silice des phtanites vient uniquement des tests de radiolaires mais il fallait quand même bien (d'après d'autres auteurs, par exemple Erhard en 1973) que la silice vienne du continent pour que les radiolaires puissent en disposer...
Donc, des processus érosifs en climat humide (circulation d'eau descendante) ont érodé des roches siliceuses et une partie de la silice a été incorporée dans les phénomènes de pédogenèsepédogenèse, en particulier dans la formation des argiles, avec des pertes plus ou moins importantes qui se retrouvent dans l'eau sous une forme ou une autre... ou encore cette silice de néoformation provient du remaniement des horizons supérieurs siliceux de sols podzoliques ou marécageux... Bref, la question n'est pas tranchée.
De même, pour les substances organiques qui selon certains ne proviennent que de la décomposition des radiolaires... et pourquoi ne pas la considérer comme la transformation possible des acides humiques des paléosols (selon certains autres)... Là non plus, la question ne semble pas tranchée... On pourrait donc considérer les phtanites comme des paléosols dégradés et silicifiés ou des dépôts siliceux qui ont été silicifiés par la suite : il y a en effet un apport notable de silice dans ces roches mais il doit être contemporain de leur formation. Il ne faut pas oublier que ces roches sont intercalées dans des schistes, ce qui rend impossible toute circulation d'eau postérieure à leur formation, puisque ces schistes sont formés à partir d'argiles plus ou moins étanches à l'eau.

D'ailleurs les auteurs anglo-saxons ne s'encombrent pas de ces différences entre phtanites et jaspilites ou d'autres encore, pour eux ce sont des cherts ou jasper ou jaspery cherts, etc. Tout ceci étant plus ou moins synonyme...