Qui ne s’est jamais émerveillé devant la perfection d’un cristal de quartz ou la forme cubique si propre d’un cristal de pyrite ? La perfection de certains cristaux peut laisser penser que la construction cristalline est régie par une organisation sans défaut des atomes. Une représentation de l’ordre absolu. Mais cette perfection n’est qu’apparente.
On considère habituellement que le processus de cristallisation menant à la formation des minérauxminéraux est gouverné par un mécanisme très ordonné que l'on peut schématiser comme une addition de blocs de constructionconstruction identiques. La façon dont seront empilés ces blocs de base, composés d'ionsions ou de moléculesmolécules, va définir le réseau cristallin, véritable signature d’un minéral. Cet empilement ne se fait pas au hasard, il s'agit d'un mécanisme régi par les lois de la chimiechimie et des interactions entre atomesatomes et molécules. Cependant, un nombre de plus en plus important d'expériences de laboratoire montre que ce modèle classique de cristallisation n'est pas si simple et que d'autres voies de cristallisation sont possibles dans la nature.
Une cristallisation loin d’être parfaite
Une équipe de chercheurs menée par Tomasz Stawski du Federal Institute for Materials Research and Testing de Berlin a étudié de près des cristaux d'anhydrite issus de la mine de Naica au Mexique, célèbre pour ses cristaux de gypsegypse géants, certains pouvant atteindre plus de 11 mètres de long. Les cristaux d'anhydrite étudiés présentent l'avantage de s'être développés tranquillement, dans des conditions particulièrement stables et proches de l'équilibre. Pendant des millénaires, aucune contrainte n'est donc venue perturber leur croissance, ce qui en fait des exemples tout particulièrement intéressants pour l'étude des mécanismes de cristallisation en milieu naturel.

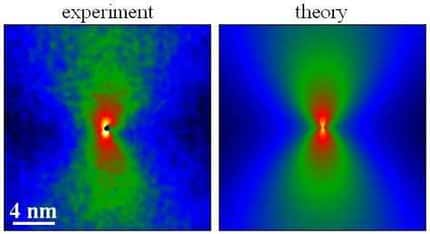
La structure cristalline de ces cristaux d'anhydrite a été passée au crible en laboratoire, grâce à différentes techniques de microscopie et à l'analyse de la diffusiondiffusion des rayons Xrayons X. Les résultats, publiés dans la revue PNAS, montrent que ces cristaux sont loin d'être parfaits et que leur structure est caractérisée par la présence de défauts d'alignement à l'échelle nanométrique, c'est-à-dire celle des atomes. Ces défauts, si petits soient-ils, sont loin d'être anodins, puisque leur présence au sein de la structure cristalline va se répercuter sur plusieurs échelles de longueur. Le cristal finalement obtenu, de taille centimétrique, ne sera donc pas parfait mais composé de vides de différentes tailles. On parle de cristaux mésostructurés, dont la structure cristalline, imparfaite, est unique pour chaque cristal.
Un jeu de Tetris raté
Pour comprendre ce processus de cristallisation, on peut imaginer un bloc de base constitué d'un assemblage d'atomes. À l'inverse du schéma classique dans lequel les blocs s'empilent à la perfection, ici les blocs ne vont pas s'emboîter parfaitement, générant des points, des lignes, voire des plans de défauts. Si la quantité et l'extension de ces défauts à l'échelle atomique sont suffisantes pour former des domaines cristallins différents (on parle de grains), le matériaumatériau est considéré comme étant polycristallin. Quand plus aucun ordre n'est observé on dit qu'il est amorpheamorphe.

Les cristaux étudiés par l'équipe de chercheurs n'appartiennent clairement à aucune de ces catégories, mais présente des caractéristiques communes à ces différents groupes. Certaines mesures indiquent que la structure est celle d'un cristal unique, d'autres montrent une signature polycristalline, et d'autres la présence de phase amorphe. Les cristaux d'anhydrite sont donc référencés comme des mésocristaux. Cette architecture cristalline provient de ces petits défauts d'alignements qui surviennent lors de l'empilement des blocs de base.
Pour schématiser leur concept, les auteurs donnent l'exemple de la nature jouant au jeu de construction Tetris, sans réussir à atteindre le but qui est de réaliser un empilement parfait à partir de petites briques de base.