au sommaire

En France, le maïs MON 810 de la firme Monsanto est à nouveau interdit d'utilisation depuis le 17 mars 2012. De nombreux doutes subsistent sur ses effets sur l'environnement et la santé. © IITA Image Library, Flickr, cc by nc 2.0
Afin d'accroître la rentabilité et la viabilité de certaines cultures, des entreprises n'hésitent pas à créer des organismes génétiquement modifiésorganismes génétiquement modifiés (OGM), à l'exemple des maïsmaïs résistants aux herbicides ou à divers parasites. Ils sont à la base de vifs débats dans de nombreux pays. En effet, les impacts écologiques et sanitaires liés à leur emploi restent largement méconnus. Question récurrente : les espèces génétiquement modifiées ne risquent-elles pas de s'hybrider avec leurs homologues sauvages, ou même avec d'autres espèces ?
Des méthodes existent déjà pour étudier la composition d'un champ en OGM, et donc d'éventuelles contaminations de cultures sauvages, mais elles sont longues à mettre en place et requièrent de nombreuses précautions. La société britannique Lumora Ltd. propose une nouvelle technique d'analyse basée sur la détection des transgènestransgènes grâce à la bioluminescencebioluminescence. La méthode Lamp-Bart est simple d'utilisation, ne nécessite pas de matériel volumineux et surtout est très sensible aux contaminationscontaminations. Elle est présentée dans la revue BMC Biotechnology.
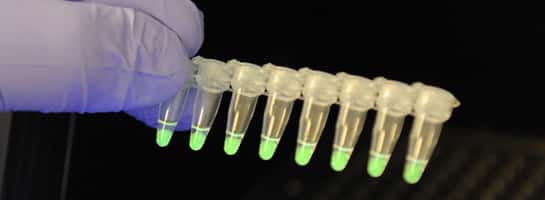
La méthode Lamp-Bart appliquée à une séquence spécifique de nucléotides rend lumineux des échantillons possédant par exemple des OGM. L'amplification de l'ADN et la mesure de la lumière émise ont lieu dans un même appareil. © Lumora Ltd.
Une amplification de l’ADN simplifiée
La détection des transgènes, les séquences d'ADNADN apportées par l'Homme, requiert tout d'abord une multiplication du nombre de séquences ciblées (i.e. une amplification). L'objectif est de fournir suffisamment de sites de réaction aux marqueurs afin de faciliter la détection d'un signal. La technique PCR (Polymerase Chain ReactionPolymerase Chain Reaction) est communément employée pour réaliser cette opération. Cependant, la procédure d'extraction est complexe et les étapes d'amplification nécessitent des changements cycliques de température et du temps.
Les chercheurs de Lumora ont donc privilégié le protocoleprotocole Lamp (loop-mediated isothermal amplification). Il permet de cibler puis d'amplifier jusqu'à 6 segments d’ADN, par exemple ceux pouvant contenir les transgènes souhaités, dans un simple tube et à température constante (environ 60 °C). Un gènegène peut être dupliqué un milliard de fois en seulement une heure grâce à une amplification exponentielle.
Un seuil de détection des contaminations OGM de 0,1 %
Le marqueur Bart (bioluminescent real time reporter), développé par Lumora, est alors utilisé pour identifier la présence des transgènes en temps réel. Le complexe moléculaire émet en effet de la lumièrelumière spontanément lors de sa fixation sur des séquences d'ADN cibles. Aucun microscopemicroscope ou sources lumineuses provoquant l'émissionémission de fluorescence ne sont requis. De plus, les résultats sont simples à interpréter : si un échantillon brille, c'est qu'il contient des OGM !
Des tests menés sur du maïs ont été concluants. La méthodologie Lamp-Bart permet de détecter une contamination de 0,1 % (i.e. la présence d'un organisme transgéniquetransgénique parmi 1.000 plantes) alors que le seuil maximal imposé par l'Europe est de 0,9 %. Ce nouvel outil va certainement faciliter l'étude des interactions existant entre les cultures sauvages et OGM, et donc nous aider à rapidement répondre à plusieurs questions de sécurité. Le suivi des OGM en culture, et potentiellement dans la chaîne alimentaire, fait donc un grand pas en avant.