au sommaire
Après l'automobile « zéro émission », la voiturevoiture « réductrice d'effet de serre » ? C'est ce qu'imaginent des chercheurs californiens qui ont trouvé, seulement au laboratoire pour l'instant. Parmi eux figure George A. Olah, prix Nobel de chimiechimie 1994 et qui milite pour une « économie du méthanol », où cet alcoolalcool serait produit par des énergies renouvelables. Il peut notamment devenir une source d'hydrogènehydrogène pour les piles à combustiblespiles à combustibles, avec l'oxygène de l'airair, produisant de l'eau et de l'électricité, ou bien être utilisé directement, dans un moteur classique, comme « carburant vert ».
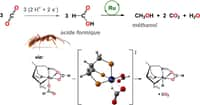
Réduire le CO2 - au sens chimique du terme - pour le transformer en méthanol (CH3-OH) nécessite, outre de l'hydrogène, un bon catalyseurcatalyseur et un chauffage à environ 150 °C. L'opération n'est pas simple car ces deux derniers paramètres étaient jusqu'à présent incompatibles, comme l'explique Surya Prakash, principal auteur de l'étude, sur le site PhysOrg. En effet, les catalyseurs qui conviendraient pour cette suite de réactions sont détruits par la chaleurchaleur.
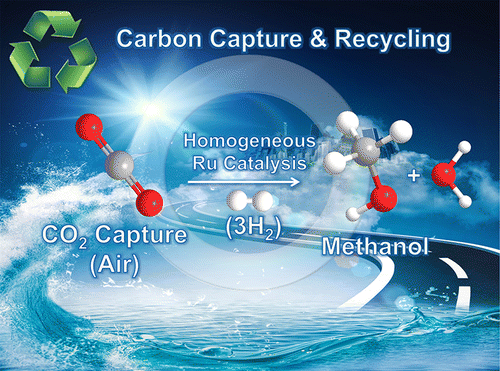
Un moyen de capturer et de recycler du gaz carbonique (CO2 ) avec un donneur d'hydrogène (H2) et un catalyseur à base de ruthénium (Ru) dit homogène (homogeneous catalysis), c'est-à-dire solubilisé avec les réactifs. Le résultat est une molécule de méthanol et de l'eau (à droite). © Jotheeswari Kothandaraman et al., Journal of the American Chemistry Society
Vers un cycle anthropique du carbone ?
L'équipe de la SouthernSouthern California University, qui vient de publier ses résultats dans la revue Journal of the American Chemical Society, annonce avoir trouvé un catalyseur réunissant les conditions nécessaires : le Ru-Macho-BH. Ce composé commercial (Macho est une marque déposée) comporte du ruthéniumruthénium (symbole Ru) et du borebore (B). Les chercheurs ont utilisé différentes sources de gaz carboniquegaz carbonique, dont, tout simplement, l'air, et ont obtenu 79 % de conversion en moléculesmolécules de méthanol. En 2014, une équipe française du CEA (Commissariat à l'énergie atomique et aux énergies alternatives) avait déjà identifié le ruthénium comme un bon catalyseur pour la synthèse du méthanol à partir du gaz carbonique.
Il faut chauffer généreusement, à 145 °C, et attendre un certain temps (70 heures). Le procédé nécessite donc une usine. Le moteur à air est encore loin mais ces unités de production pourraient fournir le précieux méthanol, destiné aux moyens de transports ainsi qu'à l'industrie chimique, qui utilise déjà abondamment cette molécule simple et réactive. Pour les auteurs, cette réaction serait un rouage d'un « cycle anthropique du carbone » (c'est-à-dire résultant essentiellement de l'intervention de l'Homme), par lequel les activités humaines produiraient du CO2 et en absorberaient autant. L'équivalent d'une photosynthèse, en somme.