au sommaire
La matière se compose d’atomes regroupés en molécules. Au plus profond de chaque atome se cache un noyau 10 000 à 100 000 fois plus petit. Celui-ci peut être stable ou instable et, alors, émettre des rayons résultant d’une intense activité entre des forces attractives et répulsives.
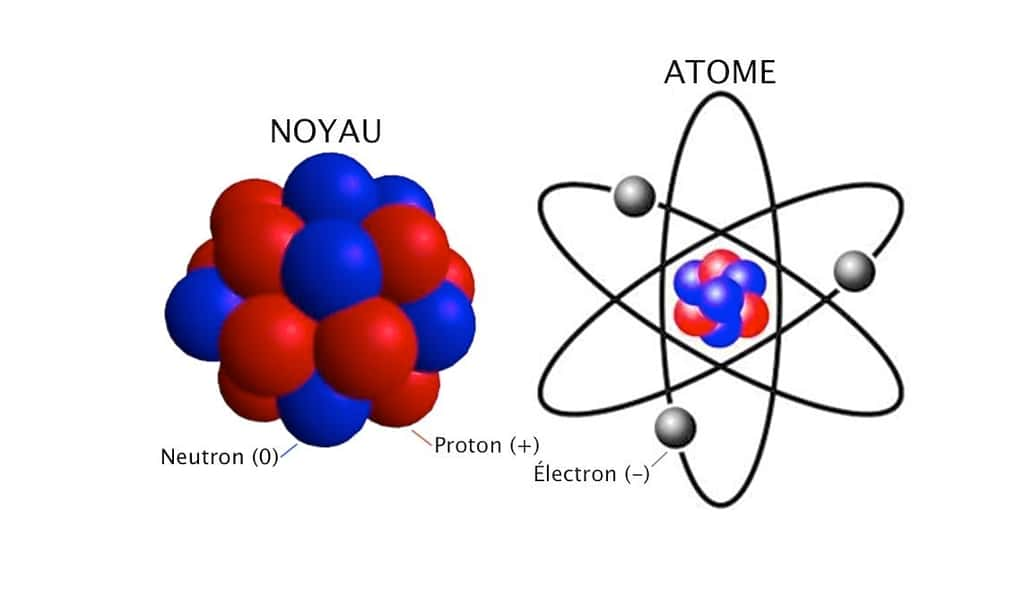
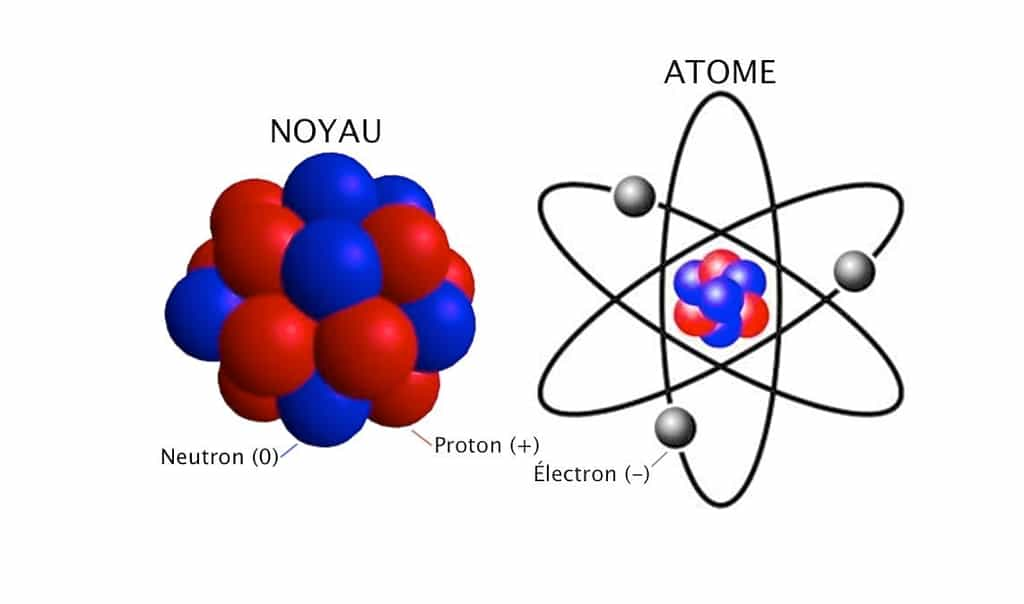
L’atome est formé d’une masse concentrée, le noyau, et de beaucoup de vide autour. Le nombre et la répartition de ses composants déterminent ses propriétés chimiques et physiques. © scrabbleenimages.wordpress.com
Les atomes mesurent un dixième de millionième de centimètre. Leur noyau est une combinaison de particules (ou nucléons) répartis entre protons, chargés positivement, et neutrons, de charge nulle. Autour gravitent des électrons, chargés négativement et environ 2000 fois plus légers. Selon les lois de l'électromagnétismeélectromagnétisme, la positivité des protons devrait les faire se repousser violemment et empêcher toute cohésion des noyaux. Si ces derniers existent, c'est pour deux raisons. D'une part, parce que les nucléons s'équilibrent en nombre et en massemasse, d'autre part, parce qu'une troisième force exerce entre eux une puissante attraction. Les physiciensphysiciens la nomment « interaction forteinteraction forte ». Les noyaux stables vivent indéfiniment à l'échelle géologique. Lorsque les protons sont plus nombreux que les neutrons, la répulsion surpasse l'attraction et entraîne l'instabilité du noyau. Cherchant à se stabiliser, celui-ci se transforme spontanément, de façon irréversible. On parle de désintégration spontanée. Ces mutations successives s'accompagnent de projections à grande vitessevitesse. C'est cela la radioactivitéradioactivité, et sa duréedurée varie considérablement d'un atome ou d'un isotopeisotope à l'autre (voir tableau). Un isotope (ou nucléide) est un atome pourvu d'une même quantité d'électrons et de protons, mais d'un nombre différent de neutrons.
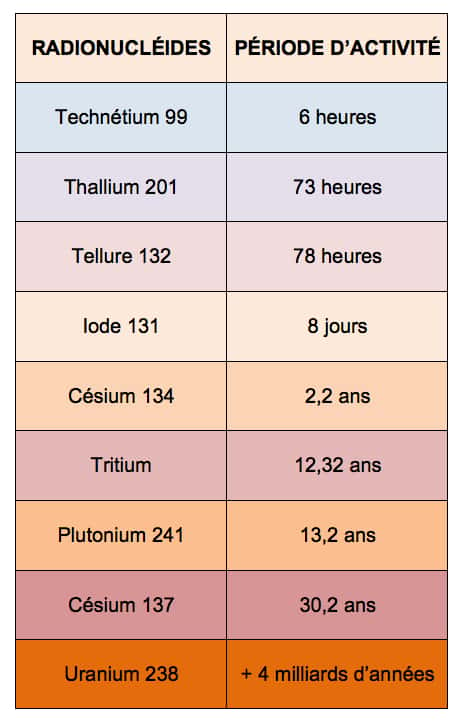
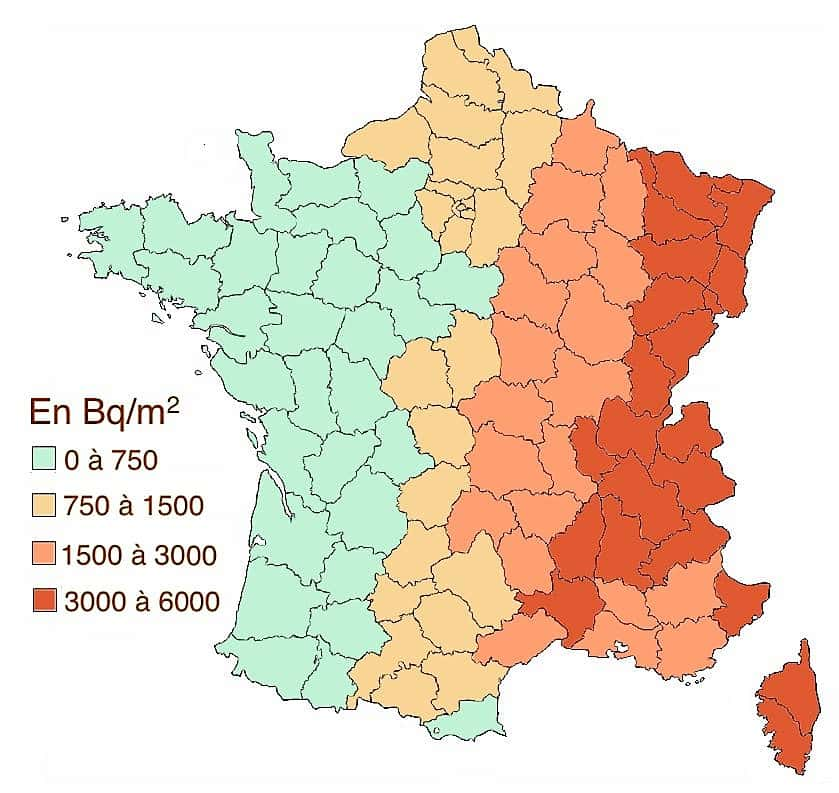
Exemples de durées de la radioactivité : On recense environ 325 isotopes naturels et 1200 artificiels. Parmi les naturels, 274 sont stables et 51 instables. L’uranium possède ainsi 17 isotopes, tous radioactifs. Ils comptent chacun 92 protons, mais leur contingent de neutrons oscille entre 125 et 150 unités. Seulement trois de ces isotopes existent naturellement sur la planète : les U-234, 235 et 238, le plus présent. Données du tableau, source IRSN (Institut de radioprotection et de sûreté nucléaire).
Un océan de rayonnements
Depuis l'utilisation de l'électricité, nous assistons au développement exponentiel d'équipements émetteurs d'ondes électromagnétiquesondes électromagnétiques : lignes à haute tensionhaute tension, antennes relais, fours à micro-ondesfours à micro-ondes, postes de radio, routeursrouteurs wi-fiwi-fi, téléphones mobilesmobiles, téléviseurs... Non radioactives, mais pas sans inconvénients, ces ondes s'ajoutent aux rayonnements ionisants venant du globe terrestre, de l'espace ou d'inventions humaines. Ces derniers, imperceptibles à nos sens, sont émis sous forme de particules (α, β...) ou d'ondes électromagnétiques comme les rayons gammarayons gamma.
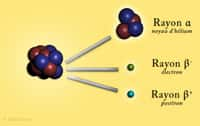
- Les particules alpha (α) sont issues d'une combinaison de deux protons et deux neutrons identique au noyau d'héliumhélium. Très agressives mais peu pénétrantes, une simple feuille de papier suffit à arrêter.
- Les particules béta (β) correspondent à deux sortes de transformations pouvant survenir dans l'isotope. Les béta moins (β-) sont interceptées par une tôle d'aluminiumaluminium ou une plaque de plexiglas. Par contre, les positons (ou positronspositrons) d'une désintégration béta plus (β+) s'avèrent aussi pénétrants que des rayons gamma.
- Le rayonnement gamma (γ) est de même nature que la lumièrelumière, les rayons Xrayons X ou infrarougesinfrarouges. Son énergieénergie et sa force de pénétration nécessitent de fortes épaisseurs d'acieracier, de bétonbéton ou de plombplomb pour s'en protéger.
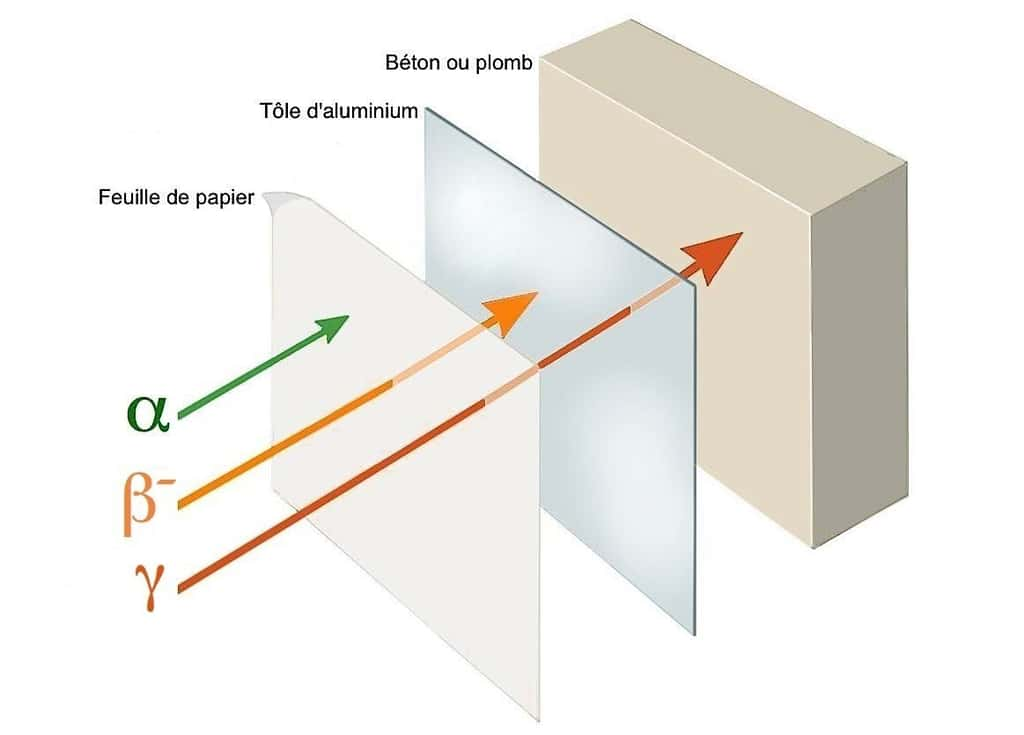
Force de pénétration des rayonnements ionisants © M.B.
Qu’en est-il des rayonnements ionisants ?
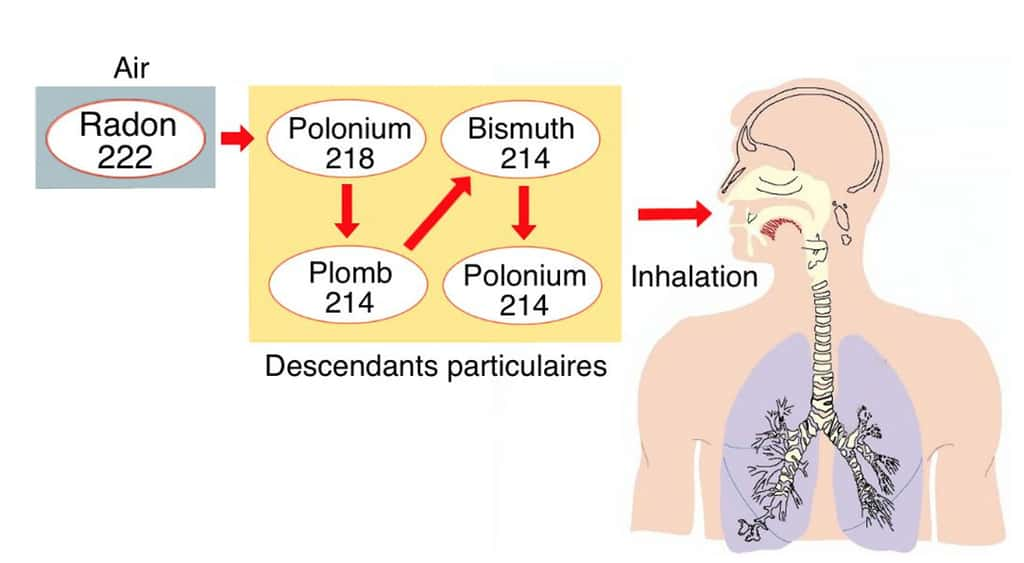
Certains éléments ont assez d'énergie pour arracher un ou plusieurs électrons aux atomes de matièresmatières qu'ils rencontrent. Ces atomes amputés d'une partie de leurs électrons se chargent positivement. Dans le même temps, les atomes voisins qui recueillent les électrons expulsés se chargent négativement. Tous ces atomes virant au plus ou au moins sont dénommés « ionsions ». Les rayonnements capables de provoquer des réactions pareilles sont dits « ionisants », que la source soit ou non radioactive. Lorsque la ionisationionisation touche les atomes des cellules vivantes, elle peut altérer leur structure moléculaire. Le niveau de gravitégravité dépend de la nature, de la durée et de l'ampleur des rayonnements.
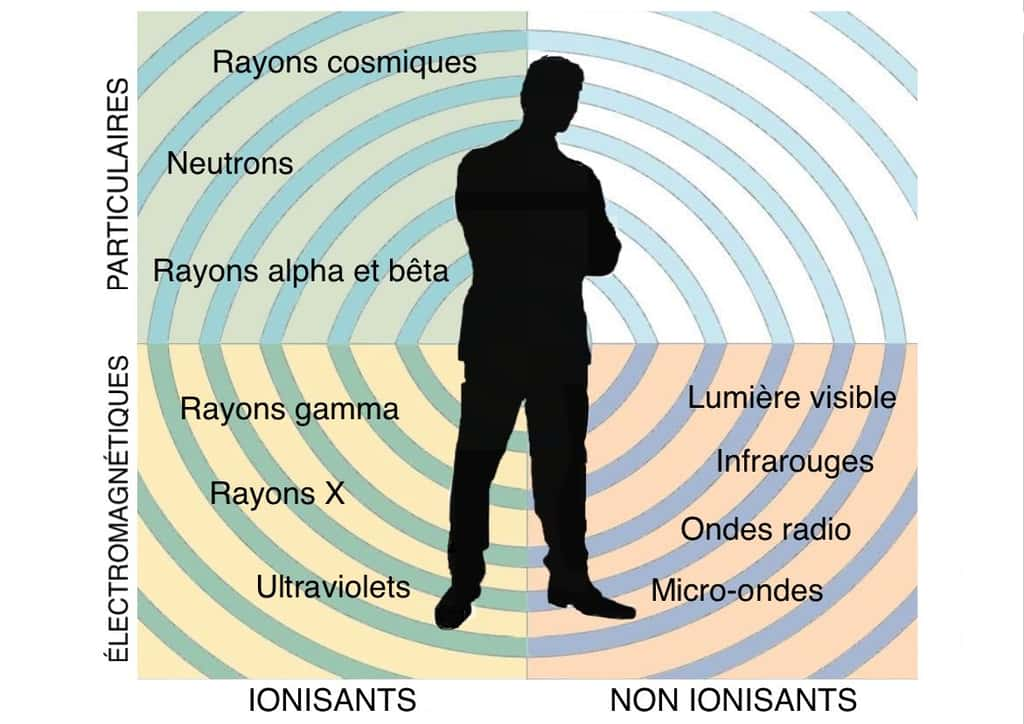
Les différents rayonnements. Illustration d’après doc du CEA © M.B.
Évaluer la force des rayonnements
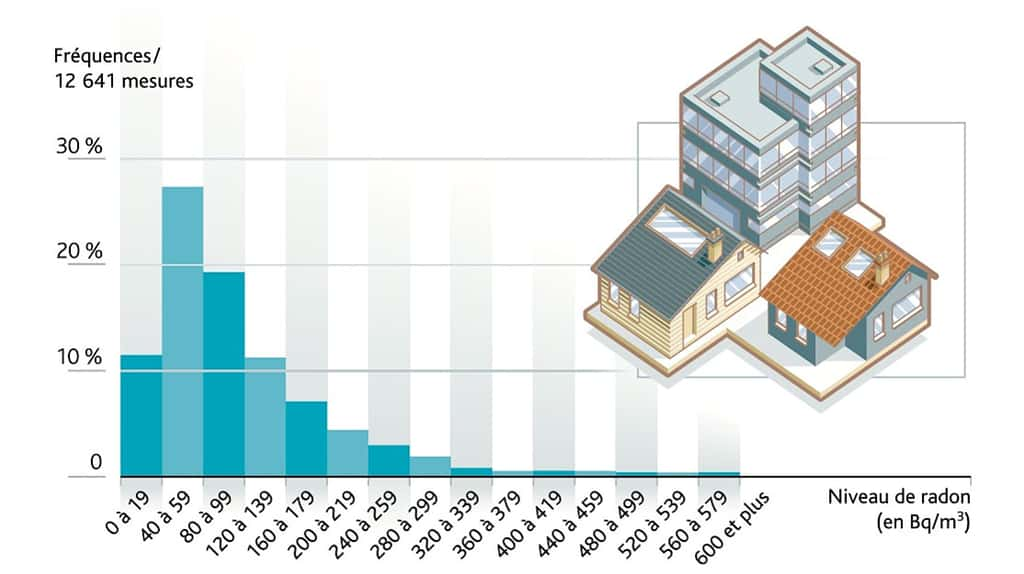
Trois unités de mesure peuvent être utilisées dans l'étude des rayonnements. Les données obtenues servent à jauger les risques en fonction de l'exposition et à mettre en œuvre les moyens adaptés à la radioprotection.
Le becquerelbecquerel (Bq) mesure l'activité radioactive en dénombrant les transformations (ou désintégrations) par seconde des noyaux instables. On peut ainsi caractériser l'ampleur d'une émissionémission de rayonnements ionisants, d'origine particulaire ou électromagnétique. Cependant, le becquerel ne permet pas d'évaluer pleinement les risques et il est inopérant face à des rayons ionisants émis par des sources non radioactives (générateursgénérateurs électriques, tubes à rayons X...). Pour cela, il faut une autre unité de mesure.
Le graygray (Gy)* est l'unité de référence pour calculer la dose ou quantité d'énergie absorbée par la matière ou l'organisme. Remplaçant le rad 100 fois plus petit, il correspond à un joulejoule par kilogrammekilogramme (j/kg) exposé de matière. On l'utilise notamment pour définir les expositions induisant des effets biologiques, comme les brûlures ou la destruction de cellules irradiées (voir plus loin). Dans le domaine des faibles ou très faibles doses, le gray est secondé par ses sous-multiples (centigray, milligray, nanogray) ou par une autre unité de dimension équivalente : le sievert.
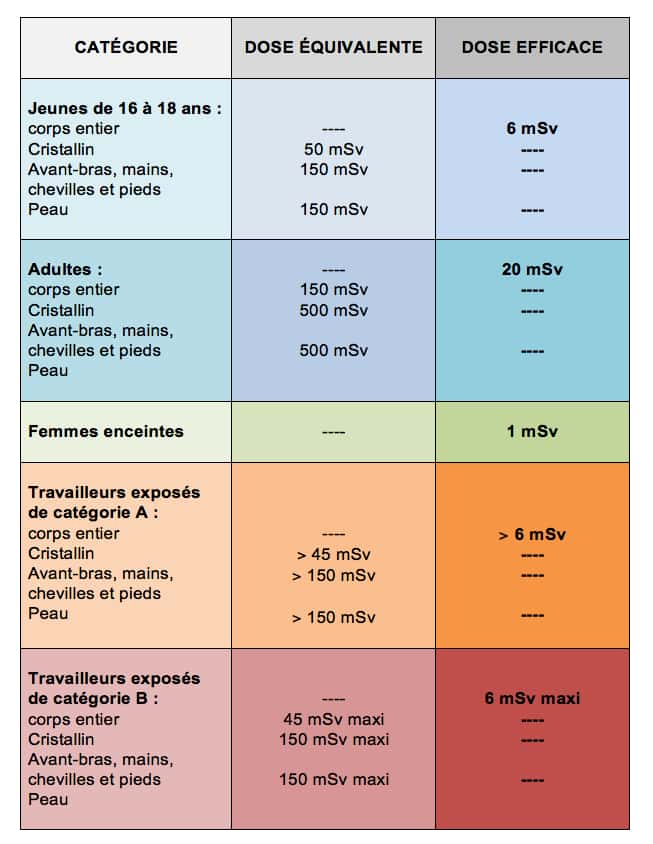
La dose efficace présente l’intérêt de pouvoir exprimer par un seul chiffre les risques qui s’additionnent lors d’expositions successives (source ASN).
Le sievert (Sv)** permet d'apprécier l'impact biologique des rayonnements. Il sert aussi à comparer les risques, notamment en termes d'effets aléatoires à plus ou moins long terme (cancerscancers, mutations génétiquesgénétiques...). Dans le premier cas, il est question de « dose équivalente », dans le second de « dose efficace ». Cette dernière se calcule en intégrant un facteur de pondération de 0,01 à 0,2 selon la sensibilité des tissus et organes irradiés. Cela facilite le suivi des travailleurs du nucléaire, des patients et des membres du corps médical spécialisé en radiographieradiographie ou radiothérapieradiothérapie.
* Physicien anglais du 20e siècle (1905-1965)
** Radiobiologiste suédois (1896-1966)