protéine thérapeutique. Par un traitement rapide et bien toléré, cette nouvelle méthode permet d'assurer une production locale et durable de ces protéines médicaments dans l'oeil.
au sommaire
De nombreux travaux chez l'animal ont démontré l'efficacité de l'administration de protéines thérapeutiques directement injectées dans l'oeil pour les pathologies cécitantes les plus fréquentes et pour lesquelles il n'existe pas de traitement chimique disponible : dystrophies rétiniennes héréditaires, proliférations fibrogliales et néovasculaires (observées au cours du diabète ou de la dégénérescence maculairedégénérescence maculaire liée à l'âge), inflammations intraoculaires ou glaucome. Des essais cliniquesessais cliniques chez l'homme ont ainsi obtenu des résultats prometteurs en traitement des dégénérescences maculaires liées à l'âge (DMLA) avec des injections répétées (toutes les 6 semaines) de protéines dans le corps vitré. Pour l'inflammation oculaireoculaire, il est aussi possible de recourir à des perfusionsperfusions de protéines par voie systémique, avec cependant des complications générales qui limitent ces traitements aux formes très sévères, et seulement pour une duréedurée faible du traitement.
L'administration prolongée et contrôlée de protéines dans l'oeil représente donc actuellement l'un des grands enjeux de l'innovation thérapeutique en ophtalmologieophtalmologie. Toutefois, l'injection fréquemment répétée de ces protéines à l'intérieur même du globe oculaireglobe oculaire reste problématique, car il s'agit d'un geste invasifinvasif mal toléré, autant sur le plan de l'oeil lui-même où ce geste est susceptible de causer des dommages, que par le patient. Ceci représente un obstacle majeur au transfert de ces résultats en traitement classique. Pour remplacer l'injection répétée de protéines, des recherches ont été menées sur le transfert - au moyen de vecteurs viraux - de gènesgènes codant pour ces protéines dans des cellules du globe oculaire, ou sur la greffegreffe intraoculaire de cellules produisant elles-mêmes ces protéines. Ces techniques, non dénuées de risques, ont apporté la preuve de leur efficacité et trouveront peut être une place dans l'arsenal thérapeutique.
Dans ce contexte, une méthode physiquephysique d'administration d'ADNADN utilisant de faibles champs électriqueschamps électriques vient d'apparaître comme une stratégie très intéressante en ophtalmologie.
Ces travaux ont abouti à la mise au point d'une méthode physique de transfert d'ADNtransfert d'ADN codant une protéine thérapeutique et utilisant de faibles champs électriques, surnommée « électrotransfert ». Ces deux équipes ont ainsi démontré, sur un modèle d'inflammation intraoculaire chez le rat, l'uvéiteuvéite induite, que l'électrotransfert de plasmideplasmide (un petit ADN circulaire) dans le muscle ciliaire lisse de l'oeil, assurait une production intraoculaire locale et soutenue de protéines dans les milieux oculaires situés de part et d'autre du muscle.
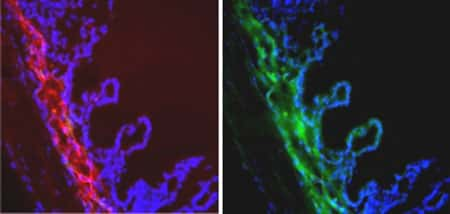
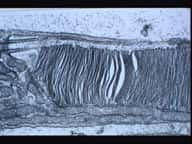
Electrotransfert de protéines dans le muscle ciliaire de l'oeil. Le procédé découvert par les chercheurs de l'Inserm et du CNRS permet d'introduire efficacement de l'ADN dans un muscle de l'œil, ici révélé en rouge à l'aide d'un anticorps. Cet ADN produit une protéine identifiée ici à l'aide de sa couleur verte (flèches). D'autres protéines telles que des protéines thérapeutiques ont pu être produites de la même manière. Les tissus avoisinants, marqués ici par leurs noyaux bleus, n'ont pas de couleur verte, ce qui démontre la précision locale de la méthode.
© U 598 Inserm - UMR CNRS 8151/ Inserm U640 Trois étapes de la vie artificielle : le canard de Vaucanson, les boucles de Langton et le Lt. Commander Data.
Les chercheurs ont administré par cette méthode un ADN plasmidique codant une protéine anti-TNFanti-TNF-a, qui neutralise une seconde protéine très inflammatoire, le TNF-a. Ils ont ainsi obtenu la production de taux thérapeutiques de protéine anti-inflammatoireanti-inflammatoire anti-TNF-a dans les milieux oculaires, production associée à une inhibitioninhibition majeure des signes cliniques et histologiques de l'uvéite. Cette production de protéine thérapeutique anti-TNF-a reste confinée au globe oculaire, évitant au patient les risques liés à une administration par voie générale. Les examens cliniques, réalisés immédiatement puis une semaine après le traitement, ont montré l'absence d'inflammation ou de dommage structural.
Ce procédé a fait l'objet d'un dépôt de brevet Inserm. Il permet, par un traitement ambulatoireambulatoire rapide (quelques secondes) et bien toléré, d'assurer une production locale et durable de protéines thérapeutiques dans l'oeil. Il ouvre de véritables perspectives thérapeutiques pour les maladies cécitantes oculaires.
Notes :
Ont collaboré à ces recherches : l'Unité 598 Inserm spécialisée dans les maladies de l'oeil et dirigée
par Francine Behar-Cohen, et l'Unité 640 Inserm /UMR CNRS 8151 (Université Paris 5 / Inserm / CNRS / Ecole Nationale. Supérieure de ChimieChimie de Paris), spécialisée en technique de transfert de gène et dirigée par Daniel Scherman
Contacts :
Contacts chercheurs
Francine Behar-Cohen (Inserm)
Tel. 01 40 46 78 46
[email protected]
Daniel Scherman (CNRS/Inserm)
Tel. 01 53 73 95 59
[email protected]
Contacts presse
Inserm
Anne Mignot
Tel. 01 44 23 60 73
[email protected]
CNRS
Gaëlle Multier
Tel. 01 44 96 46 06
[email protected]