au sommaire
Lorsque l'on se fait mal, nous ressentons une sensation désagréable qui provoque un mouvementmouvement réflexe et rapide de retrait. La douleur agit ainsi comme un signal d'alarme qui avertit notre organisme qu'un danger le menace.
Le chemin qui mène à la douleur est complexe. Des neurones spécialisés, appelés nocicepteurs, peuvent détecter les atteintes tissulaires et les signaux douloureux. Par exemple, si l'on se brûle, ils captent la sensation de chaleurchaleur, ce qui entraîne l'ouverture de canaux ioniques et la naissance d'un influx électrique dans le neurone. Le message traverse tout d'abord la moelle épinière et déclenche une réponse quasi instantanée : on se retire de la source chaudesource chaude. Il continue ensuite son chemin jusqu'au cerveau où il est interprété. Le danger est alors intégré par l'organisme qui n'ira plus appuyer à nouveau au même endroit.
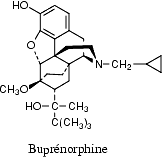
Découverte en 1804, la morphine est un dérivé de l’opium utilisé comme analgésique. Cependant, elle ne peut pas être utilisée à outrance, car elle induit une dépendance chez le patient. Elle est d’ailleurs listée comme stupéfiant au niveau international. © Wikimedia Commons, DP
La prise en compte de la souffrance des patients est essentielle lors d'un traitement. Néanmoins, les médicaments capables de calmer la douleur sont peu nombreux et ont en général une efficacité limitée, ou occasionnent des effets secondaires importants. La recherche de nouveaux analgésiques est donc primordiale. Dans une nouvelle étude publiée dans la revue Nature Genetics, des chercheurs de l'université d'Iéna en Allemagne se sont penchés sur cette question. Ils se sont intéressés au sort d'une petite fille atteinte d'analgésie congénitale, une maladie caractérisée par une incapacité à percevoir la douleur. Cette pathologie est très invalidante, car elle entraîne une forte augmentation du risque de blessures.
SNC11A, un nouveau gène de la douleur
Les scientifiques ont tout d'abord comparé la séquence génétique de la petite fille avec celle de ses parents, non atteints par cette maladie. Ils ont alors identifié un gènegène, appelé SCN11A, impliqué dans le contrôle du développement de canaux ioniques sur les neurones nocicepteurs. Ces canaux jouent un rôle essentiel dans la transmission de l’influx nerveux. Or, chez la jeune patiente, le gène SCN11A est muté et les canaux ioniques deviennent alors beaucoup plus actifs que chez les personnes sensibles à la douleur.
Il existe d'autres gènes contrôlant le développement de canaux ioniques sur des neurones nocicepteurs. Lorsqu'ils sont mutés, les canaux deviennent inactifs ce qui induit une absence de perception de la douleur. « Dans le cas de SCN11A, l'inverse se produit. Lorsqu'il est muté, on observe une augmentation de l'activité des canaux ioniques et une baisse de la sensibilité aux stimuli douloureux », explique Ingo Kurth, le directeur des travaux.
Vers de nouveaux analgésiques ?
Dans un second temps, les auteurs sont allés vérifier le rôle de ce gène chez la souris. Ils ont conçu des rongeursrongeurs possédant une version mutée de SCN11A et ont testé leur capacité à ressentir la douleur. Ils ont alors montré que 11 % des souris présentaient des atteintes identiques à celles de personnes souffrant d'analgésie congénitale, comme des fractures ou des plaies au niveau de la peau. En revanche, chez les animaux normaux, aucun ne présentait de telles lésions. D'autre part, les souris mutantes mettaient 2,5 fois plus de temps à réagir au « test de la queue », une expérience dans laquelle on mesure le temps de réaction d'une souris dont la queue est posée sur une plaque chauffante.
L'équipe travaille maintenant sur la mise en place d'un traitement contre la douleur. « Si l'on pouvait fabriquer un médicament qui rendrait les canaux ioniques contrôlés par SNC11A toujours actifs, ce serait un analgésiqueanalgésique fantastique », indique le chercheur. La tâche n'est pas simple, car il faut pouvoir moduler l'activité de certains canaux sans toucher aux autres.