Article du CNRS paru le 15 avril 2013
Véritable impasse thérapeutique, l'émergenceémergence de bactéries multirésistantes aux antibiotiques est un phénomène qui rend le succès du traitement des infections de plus en plus aléatoire. C'est particulièrement le cas en milieu hospitalier, où des bactéries multirésistantes sont impliquées dans les infections nosocomiales.
Que ce soit dans les eaux usées, ou encore chez les personnes suivant des traitements antibiotiques, ces milieux peuvent présenter une forte concentration bactérienne, avec de faibles quantités d'antibiotiques. Aujourd'hui, les effets physiologiques de ces faibles concentrations d'antibiotiques sur les bactéries et les évènements génétiques pouvant en découler sont assez mal connus. Cependant, les travaux de Didier Mazel et de Zeynep Baharoglu, respectivement chef et chercheuse au sein de l'unité PlasticitéPlasticité du génome bactérien (Institut Pasteur / CNRS) apportent un éclairage nouveau.
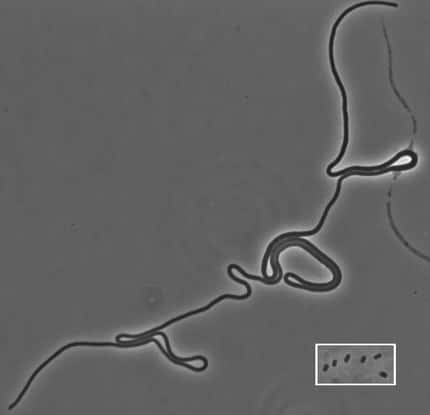
Ces chercheurs ont montré dans Plos Genetics que de faibles concentrations d'antibiotiques appartenant à la famille des aminoglycosidesaminoglycosides (utilisés dans le milieu hospitalier pour traiter de nombreuses infections) favorisent l'acquisition de gènesgènes de résistance chez plusieurs bactéries pathogènespathogènes, telles que Vibrio choleraeVibrio cholerae (l'agent infectieux du choléracholéra), ou encore Klebsiella pneumoniaeKlebsiella pneumoniae (responsable d'infections respiratoires).
Vibrio cholerae, ici à l'image, à l'origine du choléra. Sans traitement, elle peut tuer en quelques jours. Et grâce à certains mécanismes, elle arrive à développer une résistance aux antibiotiques, même à faible dose. © Zeimusu, Wikipédia, DP
Quand la bactérie sous antibiotiques crie SOS
Les scientifiques expliquent ce phénomène grâce au mécanisme suivant : les concentrations d'antibiotiques, même 100 fois moins élevées que la concentration létale, déclenchent une réponse de stressstress chez la bactérie. Appelée « réponse SOS », elle intervient lorsque l'ADN bactérien se retrouve menacé, et favorise l'acquisition de gènes de résistancerésistance par deux voies. D'une part, elle entraîne une augmentation de la fréquence des mutations du génome bactérien. D'autre part, elle active une protéineprotéine nommée intégraseintégrase, dont le rôle est d'intégrer ou d'exciser du génome bactérien des séquences d'ADNADN souvent porteuses de gènes de résistance, les intégrons.
Par ailleurs, les chercheurs ont également compris pourquoi en présence d'aminoglycosides, la réponse SOS n'avait pas lieu chez la bactérie Escherichia coliEscherichia coli, alors qu'elle est induite chez d'autres espècesespèces pourtant très proches génétiquement. La clé du mystère réside dans la stabilisation de la protéine RpoS chez Escherichia coli, qui agit comme un régulateur du stress chez les bactéries. En présence d'aminoglycosides, les chercheurs ont observé que RpoS prévient le stress oxydatifstress oxydatif engendré, lequel est à l'origine de l'induction de la réponse SOS chez les autres bactéries.
À la lumièrelumière de ces travaux, l'induction de la réponse SOS apparaît comme un vecteur essentiel à l'acquisition de nouvelles résistances bactériennes. En conséquence, les facteurs et les intermédiaires qui mènent au déclenchement de cette réponse constituent des cibles potentielles pour le développement de nouveaux traitements antibactériens. L'identification du facteur RpoS laisse également envisager le développement de possibles adjuvantsadjuvants aux antibiotiques, afin de limiter l'impact de leur effet à faible concentration.