au sommaire
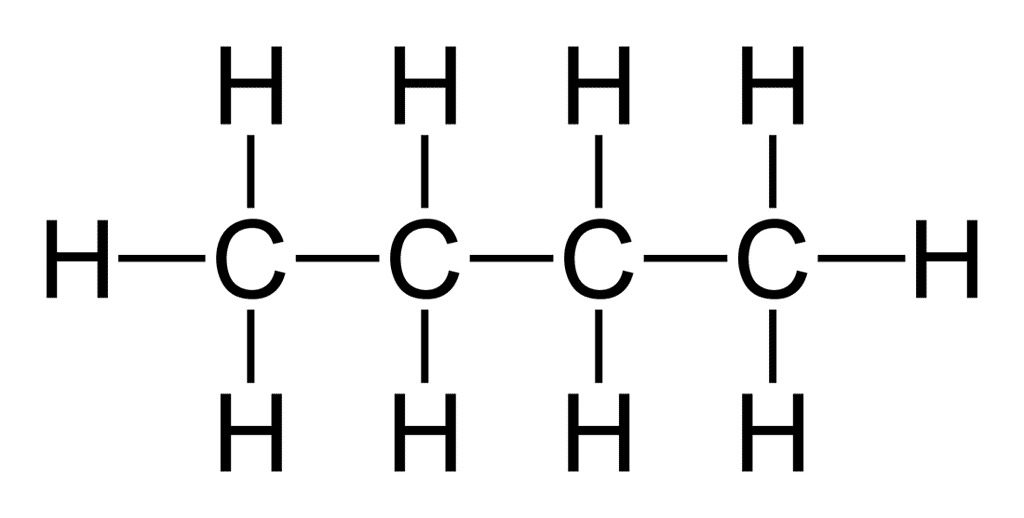
Partant de la formule brute d'une molécule, le chimiste est capable d'en écrire ce qu'il appelle une formule développée. En d'autres termes, une représentation plane de cette entité moléculaire dans laquelle on utilise des traits pour indiquer la présence de liaisons simples ou multiples entre les atomes, sans indication ou implication concernant leurs orientations dans l'espace. Cette manière d'écrire renseigne sur l'agencement des atomes dans la molécule.
Pour parvenir à écrire la formule développée d'une molécule, il est utile de connaître le nombre de liaisons covalentes que chaque atome qui la constitue est susceptible de former. Ce nombre est défini par les règles de l'octetoctet et du duet. Il est ainsi utile de savoir que l'hydrogènehydrogène ne peut former d'une seule liaison covalente simple. L'oxygèneoxygène, par exemple, peut former deux liaisons simples ou une liaison double. Et le carbone, quatre liaisons simples, deux liaisons simples et une double, deux liaisons doubles ou encore une liaison simple et une liaison triple.

Quelques exemples de formules développées
Ces deux exemples montrent l'un des inconvénients de la formule développée : elle demande beaucoup d'espace.
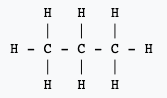
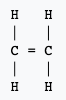
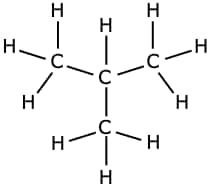
Notez que l'écriture d'une formule développée -- ou même d'une formule semi-développée qui ne représente pas les liaisons entre un atome et un atome d'hydrogène -- permet de faire apparaître des groupes caractéristiques qui influencent la réactivité de la molécule. Elle permet aussi de mettre à jour les isomèresisomères. Des molécules ayant la même composition, mais présentant des enchaînements d'atomes différents. Ainsi la molécule de formule brute C4H10 présente deux isomères :