au sommaire
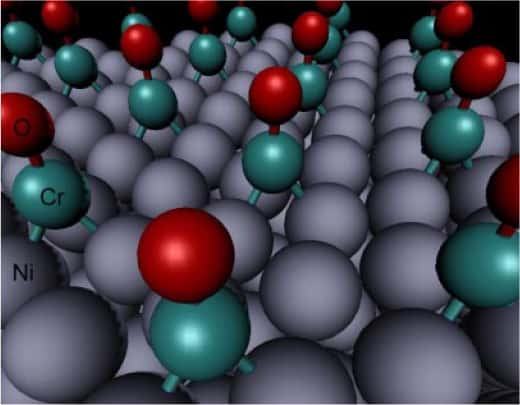
Le nickel de l'anode est traité au chrome. La réaction qui transforme l'hydrogène et l'hydroxyle (OH-) en eau est ainsi catalysée. © Lin Zhuang et al./Pnas
Dans une pile à combustiblepile à combustible, un matériaumatériau appelé électrolyte sépare les deux électrodesélectrodes. Du côté de l'une (l'anodeanode, qui émet les électronsélectrons) est amené de l'hydrogènehydrogène tandis que de l'oxygène arrive de l'autre (côté cathodecathode, donc). Entre les deux, l'électrolyte voit transiter les ionsions (le plus souvent des protonsprotons, H+, donc les noyaux d'hydrogène qui ont perdu leurs électrons), le résultat étant une émissionémission d'eau. Autour de ce principe de base existent de multiples variantes, qui diffèrent par à peu près tous les éléments. L'électrolyte, notamment, peut être un liquideliquide, ce qui présente quelques inconvénients.
Les efforts sont nombreux pour réaliser un électrolyte solidesolide, constitué d'un polymèrepolymère rendu conducteur. Il devient alors une fine membrane séparant les deux électrodes. On sait le faire depuis longtemps avec des membranes faites d'un polymère chimiquement actif, soit acideacide soit alcalin (ou basique, pourrait dire un chimiste), capable de faire transiter des ions. Le cas le plus étudié est celui des membranes acides, perméables aux ions H+. Un tel produit figure au catalogue de Dupont de Nemours, sous le nom de Nafion. Appelées PEMFC (Proton Exchange Membrane fuelfuel Cell, pile à combustible à membrane échangeuse de protons), ces piles ont par exemple été utilisées dans des missions spatiales depuis les années 1960.

Schéma de la pile à membrane alcaline (cliquer sur l'image pour l'agrandir). Du côté de l'anode (ici en nickel-chrome), l'hydrogène s'oxyde et forme de l'eau en émettant des électrons dans le circuit. Au niveau de la cathode (en argent), l'oxygène est réduit et récupère des électrons. Entre les deux, la membrane, qui constitue l'électrolyte, se laisse traverser par les ions hydroxyles (OH-). © Lin Zhuang
Mais elles peinent à sortir de ces prestigieux marchés. La raison est leur coût. Il faut leur ajouter du platineplatine, au niveau des électrodes, qui fait office de catalyseurcatalyseur pour faciliter les réactions chimiquesréactions chimiques indispensables. On voit mal comment équiper ainsi un parc mondial de voitures électriques...
Prototype prometteur
Pour se passer du platine dans les piles à combustible, les scientifiques imaginent différentes solutions. Une équipe chinoise, de l'université Wuhan, menée par LinLin Zhuang, vient d'apporter une réponse, publiée dans la revue Pnas (Proceedings of the National Academy of Sciences). Ces chercheurs ont utilisé une membrane alcalinealcaline, qui fait transiter les ions hydroxyles (OH-). Il s'agit donc d'une APEFC (alkaline polymer electrolyteelectrolyte fuel cell). Ce principe est connu depuis des lustres et utilisé sur les piles à électrolytes liquides dites AFC (alkaline fuel cell). Ce genre de membrane a déjà été utilisé mais requérait aussi du platine.

De la poudre de sulfone à ammonium quaternaire, à droite le même composé en solution et la membrane obtenue après polymérisation (QAPS, quaternary ammonium polysulphone), bien moins coûteuse que les membranes à échange de protons des actuelles PEFMC. © National Academy of Sciences, Pnas
L'équipe chinoise est parvenue à s'en passer en utilisant un polymère particulier (un polysulfone, quaternary ammonium polysulphone, ou QAPS). La cathode (l'électrode côté oxygène) est en argentargent. L'anode (côté hydrogène) est en nickelnickel, recouverte de chrome, un traitement qui empêche d'intempestives réactions d'oxydationoxydation, expliquent les auteurs, le nickel jouant le rôle de catalyseur.
Le prototype réalisé a fourni 50 milliwatts par centimètre carré de membrane à 60°C, « sans signe de dégradation durant les cent heures de l'essai ». La puissance est faible, les PEMFC actuelles fournissant quatre ou cinq fois plus. Mais cette pile n'est qu'un exercice de laboratoire qui démontre l'intérêt d'une nouvelle voie, où la catalysecatalyse est assurée par du nickel plutôt que par du platine. De quoi changer radicalement la donne industrielle et commerciale des piles à combustibles...