au sommaire
L'eau, cette denrée rare, se trouve sous plusieurs états. Découvrez ici ses propriétés puis suivez pas à pas le cycle de l'eau.

L'eau peut se décliner dans trois états différents : liquide, solide et gazeux. © MartinFuchs, DP
Quel âge a l’eau ?
L'eau liquide sur Terre est beaucoup plus ancienne que ce que l'on croyait... elle aurait 4 gyr, soit 700 Ma de plus qu'admis jusqu'à maintenant. Ce nouvel âge de l'eau, non encore confirmé, a été obtenu par Mark Harrison et Bruce Watson, du Rensselayer Polytechnic Institute américain.
Ce résultat est basé sur l'analyse de zircons dont le titane montre qu'ils se sont formés à des températures de 690 °C. Or une telle température, inférieure à 700 suggère que la planète était déjà assez froide pour abriter de l'eau liquide. Ces zircons ont 4 à 4,3 gyr et on pensait que leur formation avait lieu vers 1.000 °C. La vie aurait-elle pu se développer 700 Ma plus tôt ?
En effet, la vie telle qu'on la connaît, n'existe pour l'instant (au vu de nos connaissances) que sur la Terre : il faut, en effet, de l'eau liquide pour que la vie soit possible et la Terre est la seule planète du Système solaire où l'eau est présente sous ses trois formes : solide, liquide et gazeuse. Il semble bien, donc, que, pour l'instant, on n'ait pas de planète de rechange ! Pour en savoir plus, voir notre dossier intitulé L'eau liquide, source de vie dans l'univers.
L'eau sur Terre est maintenant un sujet très étudié, par satellite notamment, avec AquaAqua par exemple.
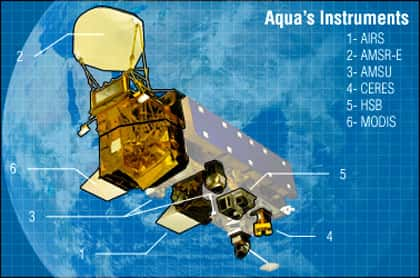
Aqua et ses instruments. © DR, reproduction et utilisation interdites
États de l'eau
Les états de l'eau sont ici donnés pour l'eau pure.
Regardons d'un peu plus près ce composé de formule H2O : c'est Cavendish qui a découvert la composition de l'eau en 1781. Rappelons juste au passage que les instruments tels baromètresbaromètres, hygromètreshygromètres, thermomètresthermomètres n'ont été mis au point et fabriqués qu'au XVIIe siècle...
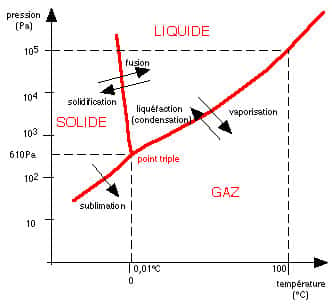
Diagramme de l'eau et ses trois états. © DR, reproduction et utilisation interdites
Propriétés de l'eau : densité…
Ajoutons encore que la densité de l'eau pure est égale à 1 à 4 °C à O m par définition et qu'elle y est maximale. Ceci a une certaine importance, comme nous l'expliquons ensuite.
Pour les autres propriétés de l'eau, voir les liens figurant en dernière page de ce dossier, mais aussi les liens suivants :
Un autre diagramme a son importance dans une étude sur l'eau (en astronomie ou planétologie), il concerne les différentes formes de glaces d'eau. Les conditions sur les autres planètes sont vraiment très différentes de celles que l'on a sur la Terre et la glace n'y est pas la même. Pour les planètes plus proches du SoleilSoleil que nous, tout s'est évaporé depuis longtemps !
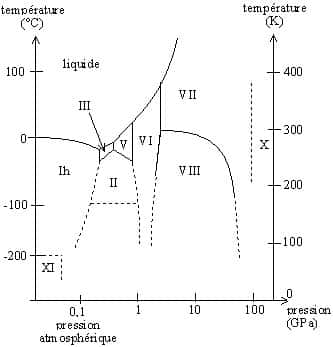
Diagramme des différentes formes de glace d'eau. © DR, reproduction et utilisation interdites
L'effet Mpemba
Qu'est-ce que l'effet Mpembaeffet Mpemba ? Deux échantillons d'eau de même volumevolume, l'un d'eau froide et l'autre d'eau chaude, sont portés à une température négative dans un congélateur. L'eau doit être la plus pure possible et aucune vibrationvibration ne doit venir perturber le système. L'eau chaude gèle plus vite que l'eau froide. C'est l'effet Mpemba qui est influencé par plusieurs facteurs :
- L'évaporation de l'eau dans l'échantillon chaud est responsable d'une perte de volume. Cette évaporation nécessite énormément de chaleurchaleur (chaleur latente due à l'énorme capacité calorifique de l'eau), ainsi la chaleur de l'eau chaude est rapidement perdue. Certains chimistes soutiennent que le fait que l'eau chaude ait moins de volume la fait geler plus rapidement. Cela est contestable car la perte de volume n'est pas assez conséquente.
- Les gazgaz dissous dans l'eau (principalement O2 et CO2) ont pour effet d'abaisser le point de congélation. Dans l'eau chaude, ces gaz s'échappent mais dans l'eau froide, ces gaz restent dans l'échantillon, ce qui explique pourquoi l'eau froide surfusionne. Ce facteur est prépondérant dans l'effet étudié.
À partir de 3.98 °C, l'eau devient moins dense, une fine pellicule de cristaux de glace se forme au niveau de l'interface eau/airair et y reste. Ceci est aussi valable pour l'eau froide. Mais dans l'eau chaude, cette congélation superficielle est plus rapide, et ce, à cause de la grande différence de température. Ce fin film de cristaux est désormais plus dense, il s'ensuit alors des mouvementsmouvements de convectionsconvections : l'eau gelée descend et l'eau chaude monte. Ce contact incessant entre l'eau chaude et la glace tend à refroidir l'échantillon brutalement et donc à le faire geler plus vite.
Note 1 : Dans l'espace, par absence de gravitégravité, les différences de densité du liquide ne provoqueraient aucun mouvement de convection. Par conséquent, l'eau chaude ne se refroidirait pas aussi vite et l'effet Mpemba n'aurait pas lieu. Une expérimentation sur ce sujet dans la future station orbitaleorbitale internationale S.S.I. permettra de le démonter.
Note 2 : Il existe l'équivalent pour l'eau entrant en métastabilité lors du changement de phase liquide-vapeur. En effet, sous la pressionpression de 1,013 Pa (1 atmosphèreatmosphère), l'eau peut rester liquide jusqu'à 120 °C. Et devinez un peu, quel est le paramètre qui produit la vaporisationvaporisation ? Un choc, bien sûr ! Le problème est donc bien cinétique.
Eau, tectonique des plaques et volcanisme
Il y a 2 cycles de l'eau sur Terre et on ne parle que très peu de celui qui concerne l'échange d'eau entre l'intérieur et l'extérieur de la Terre.
Le manteau terrestremanteau terrestre contient une quantité d'eau proche de celle des océans actuels (de l'ordre de 10 24 kgkg). Elle se présente dans le manteau sous forme d'eau d'hydratationhydratation des minérauxminéraux, d'inclusions fluidesinclusions fluides dans les minéraux, et dans les lacunes (lacunes de siliciumsilicium par exemple) ou défauts des minéraux. Il existe de l'eau dans tous les minéraux, même anhydres par exemple 10 à 150 ppmppm pour l'olivineolivine et les grenats, 500-1000 ppm pour les pyroxènespyroxènes et 50-500 ppm pour les péridotitespéridotites. On a pu faire ces dosagesdosages grâce aux xénolithes jusqu'à des profondeurs de 500 km. Pour ce qui se passe plus bas on procède par expérience en laboratoire ou par simulation et on obtient des chiffres comme 1.200 ppm d'eau dans l'olivine à 13 GPa... donc, il PEUT y avoir de l'eau et on SAIT où la mettre ! La dynamique de l'eau dans le manteau est beaucoup plus lente qu'en surface, de l'ordre de centaines de millions d'années. N'oublions pas de mentionner encore que l'eau présente dans une roche favorise l'abaissement de son point de fusionfusion ce qui est très important dans le volcanismevolcanisme.
Cette eau reste piégée dans les basaltesbasaltes des dorsales océaniquesdorsales océaniques, la pression étant trop grande pour un bon dégazagedégazage. Mais ce n'est pas le cas dans un volcanvolcan dont les laveslaves sortent à l'air libre et il émet des quantités de vapeur d'eau. D'autre part il y a toute une chimiechimie de l'eau au fond des océans, mais on sort du sujet...
Lors des phénomènes de subductionsubduction, la plaque qui s'enfonce perd de son eau (jusqu'à 13% pour l'olivine en cas de subduction chaude). Dans le cas des basaltes, ils sont altérés par l'eau de mer quand ils arrivent en subduction et que la subduction soit chaude ou froide, la quantité de lawsonite ne varie pas beaucoup, c'est donc une possibilité d'entraîner de l'eau assez loin à l'intérieur de la Terre, mais seulement 1% de cette eau descendra à de grandes profondeurs...
Il y a donc un « cycle de l'eau » entre l'intérieur et l'extérieur de la planète !
L'eau douce naturelle : glacier, nappe souterraine, rivière, fleuve et lac
L'eau de la nature n'est jamais pure et on y trouve beaucoup de choses. Voici, à titre indicatif et comme exemple, la composition de l'eau du lac Tanganyika :
- PH : 8,9
- Somme cationcation : 460 meq/l
- Somme anionanion : 7,38 meq/l
- Na : 7,48 mg/l
- K : 60,3 mg/l
- Ca : 29,8 mg/l
- Mg : 12,7 mg/l
- HCO3 + CO3 : 41,8 meq/l
- Cl : 6,47 mg/l
- SO4 : 27,2 mg/l
- SiO2 : 9,2 mg/l
- PO4-P : 3,5 µg/l
À propos de l'eau naturelle, il y a nécessité de tenir compte du potentiel redox et du pH de l'eau, les différents composés du mélange qu'est l'eau naturelle interviennent et modifient ces données. Ils délimitent une « zone » de stabilité de l'eau comme le montre ce graphique :
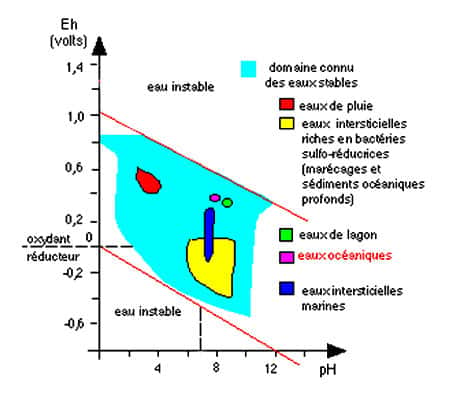
Eh en fonction du pH de l'eau. © Comprendre et enseigner la planète terre, Ophrys 1989, reproduction et utilisation interdites
Dans ce graphique, Eh est une mesure de la concentration des électronsélectrons en solution (en VoltsVolts). Le pH est une mesure de la concentration en protonsprotons (H3O+) en solution (en unités pH). Les domaines des différentes eaux sont donc caractérisés par des potentiels rédoxrédox différents et un pH différent ce qui explique la solubilité des autres ionsions dans ces eaux et donc leur comportement dans l'altération ou la précipitation de tel ou tel sel. Dans les domaines instables de l'eau, les éléments chimiqueséléments chimiques oxydent ou réduisent l'eau.
L'oxygène dans l'eau
La quantité d'oxygèneoxygène dans l'air est de 20 % environ, il n'en va pas de même dans l'eau et de loin. Indépendamment des adaptations biologiques corrélatives l'oxydationoxydation des matièresmatières organiques est plus difficile dans l'eau. Voici un schéma qui montre bien cette différence !
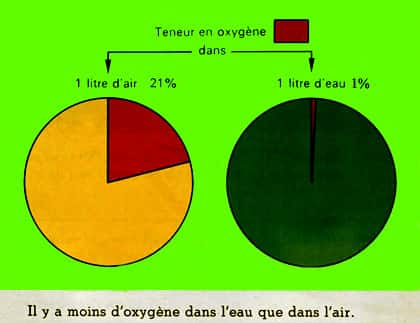
Teneur en oxygène de l'eau et de l'air. © DR, reproduction et utilisation interdites
D'autre part la teneur en oxygène de l'eau, qu'elle soit salée ou non, dépend fortement de la température, une eau chaude est, très vite, très pauvre en oxygène, même saturée d'air. C'est la solubilité des gaz qui diminue avec la température, phénomène physiquephysique lié à l'agitation moléculaire qui augmente avec la température. On voit, pour le graphique ci-dessous, que l'eau des régions équatoriales (25-30°) est très pauvre en oxygène contrairement à celle des régions polaires (<10°) ce qui a des conséquences évidentes sur la biomassebiomasse de ces régions.
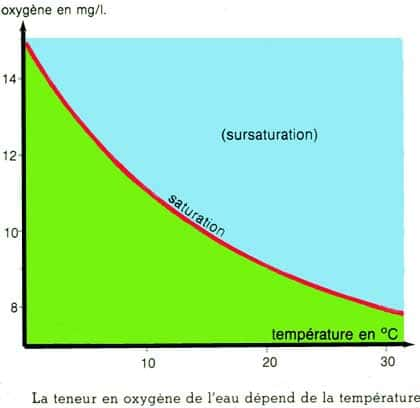
Teneur en O2 dans une eau saturée d'air en fonction de la température. © DR, reproduction et utilisation interdites
Cycle de l'eau
Dalton a dit : « L'évaporation des surfaces terrestres doit être inférieure aux précipitationsprécipitations sinon les rivières ne pourraient pas couler ».
Voyons maintenant quel est le trajet d'une moléculemolécule d'eau sur la planète ! Et, nous commencerons (arbitrairement !) avec l'évaporation de l'eau à la surface de l'océan. Cette évaporation dépend de la température, du ventvent, de la teneur en eau de l'air environnant (l'humidité de l'airhumidité de l'air), des mouvements de surface de l'eau des océans et sans doute d'autres facteurs encore.
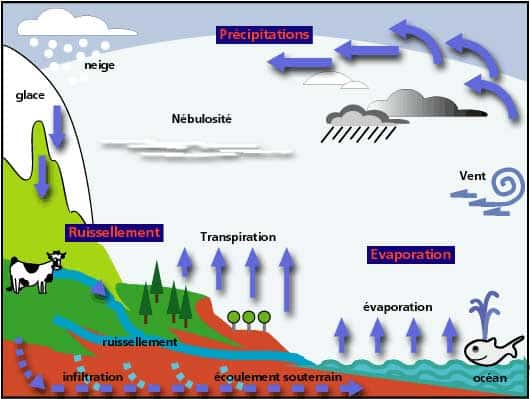
Schéma simple du cycle de l'eau. © DR, reproduction et utilisation interdites
Le phénomène est le même à la surface des continents, mais s'ils sont couverts de végétation il faut tenir compte de la transpirationtranspiration de ceux-ci qui provoque de la vapeur qui diffuse dans l'air. Le transittransit d'eau dans un végétal peut être très important, de l'ordre de grandeurordre de grandeur de tonnes par jour pour de grands arbresarbres. Quand toute cette vapeur d'eau rencontre une région plus froide, soit en latitudelatitude soit en altitude, elle se condense et il se forme des nuagesnuages...

Nuages. © DR, reproduction et utilisation interdites
Quand ces nuages rencontrent un obstacle qu'il soit géographique ou thermique, il pleut. Après les précipitations (pluie, neige, averse, bruinebruine ...) l'eau peut suivre plusieurs chemins : le ruissellement en surface, la pénétration dans le sol par infiltration ou percolationpercolation, l'évaporation immédiate (parfois même avant de toucher le sol dans le désertdésert !) l'absorptionabsorption directe (pour une petite partie) par les feuilles...

Erosion par ruissellement. © DR, reproduction et utilisation interdites
Le ruissellement (et l'érosion qui s'en suit, en particulier l'érosion des terres cultivables) est un facteur très important dans les régions où le déboisement est important, par exemple une partie des problèmes du Bangladesh sont dû à l'érosion par ruissellement (déboisement) en amont dans l'Himalaya.
L'infiltration et la percolation sont, elles, dépendantes de la nature su sol et de son comportement vis-à-vis de l'eau et il y a plusieurs situations pour l'eau entre les grains d'un sol
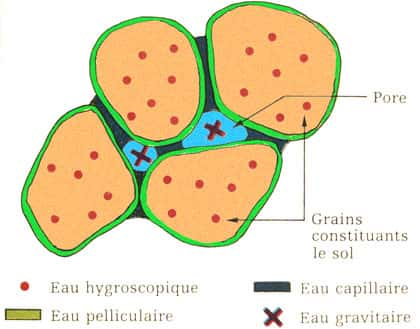
L'eau dans le sol. © DR, reproduction et utilisation interdites
Cette eau peut aussi être stockée, un temps plus ou moins long, dans des aquifèresaquifères à nappe libre liées à des cours d'eau (nappe alluviale), des aquifères à nappes libres non liées aux cours d'eau directement mais alimentées par des eaux de pluie principalement et des d'aquifères à nappes captives.
Les nappes phréatiquesnappes phréatiques et alluviales par exemple ont des taux moyens de renouvellement faibles (colonne de gauche) et des duréesdurées de renouvellement longues (colonne de droite).
Sur notre planète, la surveillance du cycle de l’eau est indispensable à la compréhension du réchauffement climatique. Le Cnes nous parle, au cours de cette vidéo, des différentes missions spatiales qui, depuis plusieurs années déjà, permettent de suivre l'eau tout autour du Globe. © Cnes
L'eau fossile, une ressource épuisable
Il est donc clair que l'eau « fossilefossile » représente alors une ressource épuisable.
Ceci est dû aux roches sous-jacentes qui ont des porositésporosités et des perméabilités différentes. Voici quelques exemples :
- Porosité totale : propriété d'un milieu, d'un sol ou d'une roche de comporter des pores, c'est à dire des vides interstitiels interconnectés ou non. Paramètre qui l'exprime : rapport du volume de ces vides au volume total du milieu
- La porosité efficace (Castany, 1961) est le rapport du volume d'eau gravitaire qu'un milieu poreux peut contenir en état de saturation puis libérer sous l'effet d'un drainagedrainage complet (égouttage en laboratoire sur échantillon), à son volume total. Terme complémentaire de la capacité de rétention.
| Bassin du Sahara septentrional (Algérie, Tunisie) | 1,4.10-5 | 70.000 |
| Aquifère des sablessables verts du bassin de Paris | 5.10-5 | 20.000 |
| Aquifères à nappe libre de l'Arizona (USA) | 2,5.10-4 | 4.000 |
| Aquifères du bassin de Maranhao (Brésil) | 13.10-4 | 800 |
| roche (non fracturée) ou sédimentsédiment | porosité totale (L.m-3 de roche saturée) | porosité efficace (L.m-3) | perméabilité (m.s-1) |
| argileargile | 400-500 | 10-20 | 10-7 - 10-10 |
| calcairecalcaire | 10-100 | 10-50 | 10-2 - 10-6 |
| craiecraie | 100-400 | 10-50 | 10-3 - 10-5 |
| granitegranite | 1-50 | 1-20 | 10-5 - 10-10 |
| gravier | 200-400 | 150-250 | 10-2 - 10-4 |
| grèsgrès | 50-250 | 20-150 | -- |
| sable fin | 300-350 | 100-150 | 10-3 - 10-6 |
| schiste | 10-100 | 1-20 | 10-7 - 10-10 |
Mais l'eau peut aussi restée fixée pendant des temps très longs à la surface de la Terre dans les glaciersglaciers ou les inlandsisinlandsis, ce stockage peut être de plusieurs dizaines de milliers c'est le temps qu'il faut à la goutte d'eau tombée sur le glacier pour se retrouver dans le torrenttorrent sous-glaciaire. Un glacier fonctionne selon le schéma résumé ci-dessous :
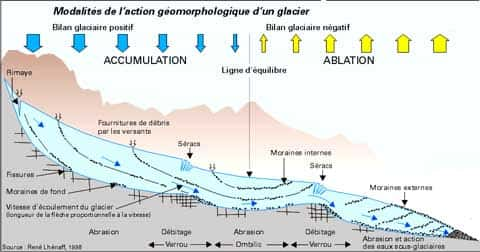
Géomorphologie d'un glacier alpin © DR, reproduction et utilisation interdites

Glacier de montagne. © DR, reproduction et utilisation interdites