au sommaire
Deux chercheurs du CEA (Commissariat à l'énergie atomique et aux énergies alternatives), Étienne Roth et Jacques Labeyrie, sont considérés comme des pionniers de l'analyse isotopique de l'eau. Grâce à eux, cette technique permet désormais de reconstruire les variations passées de notre climatclimat.
La question m'a été souvent posée : comment se fait-il que des chercheurs du CEA (Commissariat à l'énergie atomique et aux énergies alternatives) s'intéressent à l'évolution de notre climat, un domaine a priori assez éloigné des missions de cet organisme ? Certes la relation entre énergie et effet de serreeffet de serre peut justifier un tel intérêt, mais les premières publications du CEA remontent aux années 1950, époque à laquelle quasiment personne ne se souciait du lien, désormais avéré, entre activités humaines et réchauffement climatiqueréchauffement climatique. Il faut chercher ailleurs et plus précisément saluer l'enthousiasme et l'esprit visionnaire de deux chercheurs récemment disparus, Étienne Roth et Jacques Labeyrie - qui ont tous les deux intégré cet organisme en 1946, quelques mois après sa création par le Général de Gaulle - et de leurs équipes.

Svitjodbreen Glacier, Svalbard. © Allan Hopkins, CC by-nc 2.0
Analyse isotopique : les travaux d'Étienne Roth et Jacques Labeyrie
Après s'être familiarisé aux États-Unis et au Canada avec la technique de la spectrométrie de masse utilisée pour mesurer les compositions isotopiques, Roth a créé et dirigé des équipes de recherche sur les procédés d'enrichissement isotopique ; il s'est intéressé, en particulier, à celui de l'hydrogène en vue de la fabrication de l'eau lourde, D2O, formée de deux atomes d'hydrogène lourd (isotopeisotope stable de l'hydrogène avec un neutronneutron, communément désigné sous le nom de deutérium, D) et d'un atome d'oxygèneoxygène. En parallèle, il se passionne pour les potentialités offertes par l'étude des variations naturelles de cet isotope dans différents domaines. Ces activités, regroupées au sein du LGI (Laboratoire de géochimie isotopique), couvrent un spectrespectre très large, allant de l'analyse des jus de fruits afin de préciser leur provenance à celle des neiges et des glaces du Groenland et de l'AntarctiqueAntarctique.
De son côté, Jacques Labeyrie s'intéresse avant tout aux isotopes radioactifs, qu'ils soient naturels ou artificiels. Il développe des instruments dédiés et met en place un programme d'observations atmosphériques à partir de sondes et de ballonsballons, programme qui constitue l'un des éléments à l'origine des recherches en astrophysiqueastrophysique au CEA. Avant tout curieux de l'histoire de notre planète, il crée, en 1961, le CFR, le Centre des faibles radioactivitésradioactivités (CEA-CNRS), avec l'objectif d'utiliser la radioactivité naturelle et artificielle pour décrire précisément les phénomènes qui ont marqué cette histoire et d'en préciser la chronologie grâce aux isotopes radioactifs tels que le carbonecarbone 14.
Le deutérium et l'oxygène 18, des isotopes lourds
Il est un domaine où les passions d'Étienne Roth et de Jacques Labeyrie sont remarquablement complémentaires, celui de la reconstruction des variations passées de notre climat, pour laquelle l'approche isotopique constitue un outil de choix. En premier lieu, la moléculemolécule d'eau H216O et ses deux formes isotopiques, HDO, dans laquelle un des atomes d'hydrogène est remplacé par un atome de deutérium, et H218O, dans laquelle l'oxygène 18 prend la place de l'oxygène 16. Par la suite, nous désignerons ces molécules, un peu abusivement, par l'expression « isotopes de l'eau ».
Dans les années 1950 et 1960, les travaux du glaciologue danois Willi Dansgaard ont mis en évidence une relation entre la composition isotopique des précipitationsprécipitations et leur température de formation, très bien documentée dans les moyennes et hautes latitudeslatitudes : plus il fait froid, moins la pluie et la neige contiennent d'isotopes lourds (deutérium et oxygène 18).

Flocons de neige au microscope électronique. © DP
Les neiges des régions froides, pauvres en isotopes lourds
Cette relation résulte des fractionnements isotopiques affectant la molécule d'eau à chacun de ses changements de phase. Les gouttelettes et les cristaux de neige sont plus riches en isotopes lourds que la vapeur d'eau qui leur donne naissance, si bien que la vapeur d'eau restant dans la masse d'airmasse d'air - et donc les précipitations qui s'y forment - s'appauvrit en isotopes lourds à mesure que cette quantité de vapeur d'eau diminue. Cette quantité dépend de la pressionpression de vapeur saturante qui diminue avec la température. Résultat, plus il fait froid, moins une masse d'air peut contenir de vapeur d'eau et ce sont les neiges des régions polaires, les plus froides de notre planète, qui sont les plus pauvres en isotopes lourds. Les neiges qui tombent dans les régions les plus froides de l'Antarctique contiennent près de deux fois moins de deutérium que les eaux océaniques (figure 1 ci-dessous). D'où l'idée que les variations de composition isotopique mesurées le long des carottagescarottages réalisés dans les calottes glaciairescalottes glaciaires permettent d'accéder aux variations passées de la température. Cela vaut aussi bien pour le deutérium que pour l'oxygène 18, dont les variations, liées aux mêmes processus de fractionnement, sont très fortement corrélées.
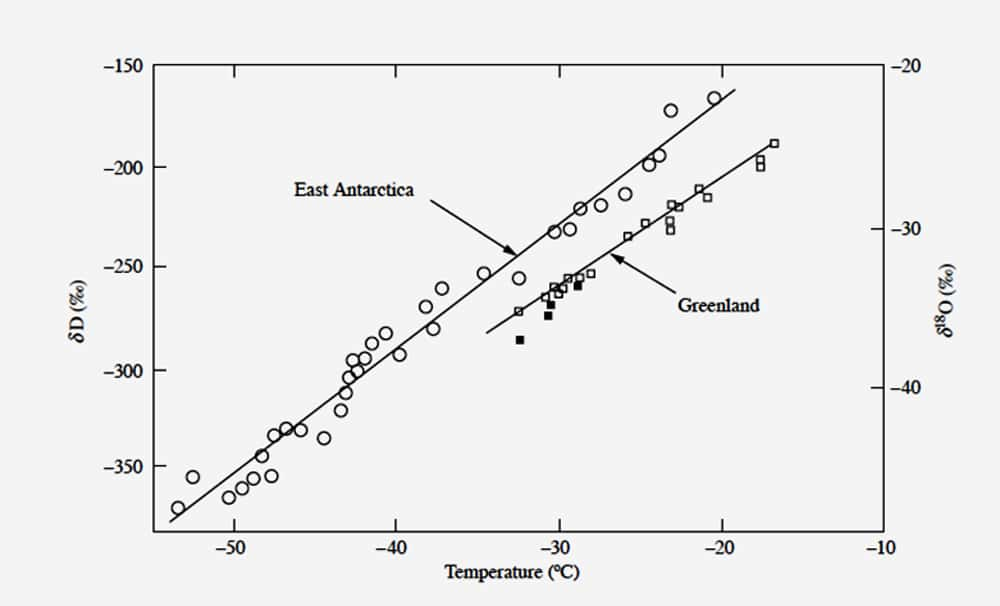
Figure 1 : Cette figure illustre la variation des teneurs moyennes en deutérium (échelle de gauche) et en oxygène 18 (échelle de droite) des neiges récentes de l’Antarctique de l’Est et du Groenland (analysées respectivement à Saclay, en France, et à Copenhague, au Danemark) en fonction de la température moyenne annuelle du site. © Jean Jouzel, tous droits réservés
Analyse isotopique et variations passées du niveau de la mer
En outre, en période glaciairepériode glaciaire, l'accumulation de glace pauvre en isotopes lourds sur les régions continentales de l'hémisphère Nordhémisphère Nord - synonyme de baisse des niveaux des mers - correspond à une augmentation mesurable de la composition en oxygène 18 de l'océan. Celle-ci se retrouve dans la composition de la calcitecalcite d'animaux marins tels que les foraminifèresforaminifères. Les paléocéanographes utilisent largement cette propriété pour retrouver des informations sur les variations passées du niveau de la mer à partir de l'analyse de sédimentssédiments marins dont les équipes du CFR se sont fait la spécialité.



















