au sommaire
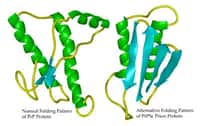
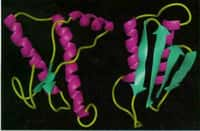
La protéine du prion existe sous deux formes, l'une pathogène et l'autre « normale », différant par leur structure tridimensionnelle.
En Europe, depuis 2002 le système de surveillance de la tremblante chez les petits ruminants (moutons, chèvres) a été intensifié. Cette surveillance s'opère notamment à l'aide de tests dits "rapides" sur des prélèvements effectués à l'équarrissage ou à l'abattoir, et basés sur la détection biochimique de la forme anormale de la protéineprotéine prionprion PrP, responsable de l'infectiosité et de la transmission de cette maladie neurodégénérativemaladie neurodégénérative.
Il est apparu que parmi les échantillons trouvés positifs avec l'un des tests (environ 20 à 50%) donnaient un résultat négatif avec d'autres tests également validés pour la détection de la tremblante classique. Il était donc jusqu'à aujourd'hui difficile de trancher sur le statut de ces échantillons, qualifiés de discordants, et de savoir s'ils correspondaient à des faux positifs, ou s'ils reflétaient réellement un processus infectieux, dans la mesure où ces animaux étaient cliniquement sains (abattoir) ou de statut clinique non documenté (équarrissage). De plus, parmi ces cas discordants, les chercheurs ont observé que se trouvaient des animaux porteurs de gènesgènes PrP conférant naturellement une forte résistancerésistance vis-à-vis de la tremblante classique.
Parallèlement, en Norvège, les chercheurs ont identifié depuis 1998 plusieurs cas d'ovins présentant un profil clinique et histopathologique inhabituel et une signature biochimique atypique comparée à celle de la tremblante classique. Ce profil atypique a été appelé Nor98.
Les chercheurs de l'INRA ont étudié les échantillons discordants de cerveaucerveau de moutons et de chèvre collectés par l'AFSSAAFSSA de Lyon et analysés par le réseau de typage national des souches de tremblante en France ainsi que des isolats de Nor98, collectés en Norvège.
Pour évaluer la nature pathogènepathogène ou non des échantillons, les chercheurs ont utilisé un modèle, conçu à l'INRA, de souris dites "ovinisées", c'est-à-dire qu'elles expriment la protéine PrP ovine normale. Ces souris, auxquelles ils ont inoculé des échantillons discordants, ont toutes développé une maladie à prion, qui a été confirmée par les analyses de leurs cerveaux.
De plus, la protéine prion anormale qui s'accumule dans le cerveau de ces souris malades présente des caractéristiques biochimiques similaires à celles observées dans le cerveau des moutons Nor98 et discordants, et qui rendent inopérants certains des tests biochimiques en vigueur actuellement.
Les chercheurs ont également déterminé que les échantillons discordants étudiés et les Nor98 correspondaient très probablement à une seule et même souche. On ignore encore si cette souche peut provoquer des signes cliniques chez les moutons résistants. D'autre part, la transmission expérimentale aux souris ne présage pas de l'aptitude à se transmettre à d'autres animaux dans les conditions naturelles.
Il reste à déterminer si tous les cas discordants sont de type Nor98, ou s'il existe d'autres souches de prion non identifiées à ce jour.