L’astringence, ou la sensation de bouche qui s’assèche, fait la réputation de certains aliments, notamment le bon vin. Cette propriété vient d’être observée sous le rayonnement ultraviolet par des chercheurs français, alors que les techniques classiques ne permettaient pas de le voir.
au sommaire
En dégustant une groseille pas vraiment mûre, une tasse de thé ou un verre de vin, la sensation est la même. Comme si, soudain, l'intérieur de la bouche s'asséchait : c'est l'astringence. Pour la première fois, les mécanismes d'interactions moléculaires responsables de cette sensation ont été identifiés par des chercheurs de l'Inra, de l'université Paris‐Sud et du CNRS, en collaboration avec des équipes du synchrotron SoleilSoleil, grâce à une méthode utilisant le rayonnement ultraviolet. Ces travaux viennent d'être publiés sur le site de la revue Angewandte Chemie.
L'astringence fait partie intégrante du plaisir que peuvent procurer certains mets ou boissons et participe à la qualité de ces aliments. À l'origine de cette sensation : l'interaction entre les tanins (des moléculesmolécules produites par les plantes) et des protéines présentes dans la salive dites PRP pour protéines riches en proline. Cette interaction vise à piéger les tanins (avant leur passage dans le système digestif) et diminue la lubrification des muqueuses de l'intérieur de la bouche. Ce phénomène intervient dans la sensation de sécheressesécheresse buccale typique de l'astringence.
La bouche sèche passée au crible des UV
Si des chercheurs de l'Inra, au sein de l'unité Sciences pour l’œnologie, ont montré comment les protéines PRP se repliaient autour des tanins pour les piéger, le site d'interaction exact entre les deux composés chimiques n'avait pas encore été clairement identifié. En effet, ces protéines sont dites « intrinsèquement désordonnées », c'est‐à‐dire qu'elles ne possèdent pas de structure tridimensionnelle bien définie, ce qui rend difficile - voire impossible - l'utilisation des méthodes d'analyse classiquement utilisées pour déterminer cette structure (biocristallographie, RMNRMN).
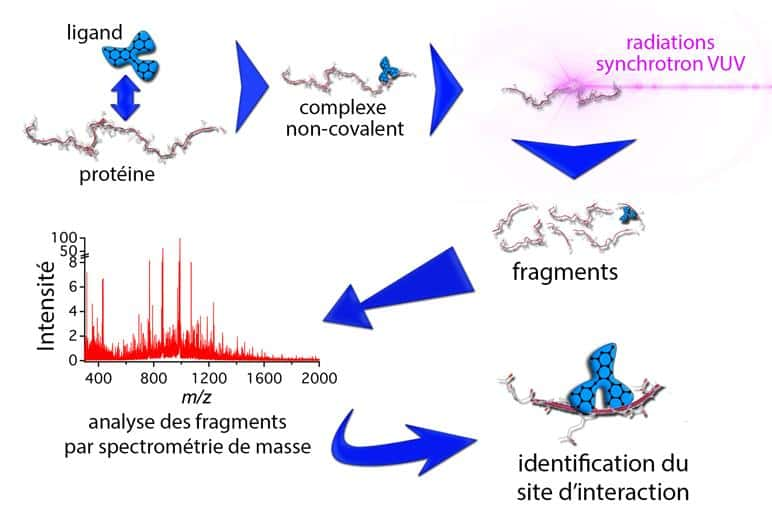
Grâce à la mise au point au synchrotron Soleil d'une nouvelle méthode, impliquant le rayonnement synchrotronrayonnement synchrotron dans l'ultravioletultraviolet lointain, couplé à la spectrométrie de massespectrométrie de masse, les chercheurs ont pour la première fois localisé le site d'interaction d'un tanin sur une PRP (la protéine IB5).
Le choix judicieux de l'énergieénergie du rayonnement synchrotron a permis de cibler l'assemblage PRP-tanin, et de le fragmenter : mais les liaisons pourtant fragiles entre les deux composés sont conservées, intactes. Les fragments de PRP toujours fixés au tanin ont ensuite été analysés au moyen de la spectrométrie de masse, permettant d'identifier les parties de la protéine où se lie le tanin. Si cette technique donne pour la première fois accès aux mécanismes d'interaction entre PRP et tanins, il s'agit plus globalement d'une méthode universelle, particulièrement adaptée à l'étude des protéines intrinsèquement désordonnées, réfractaires aux autres types d'analyses. Parmi les candidats potentiels se trouvent notamment des protéines de régulation du fonctionnement cellulaire ou des protéines impliquées dans différentes pathologies.