au sommaire
Ce jeudi, un comité de vingt-deux experts américains indépendants s'est réuni dans le New Hampshire et recommande à une très large majorité à la Food and Drug AdministrationFood and Drug Administration (FDA, l'agence américaine du médicament) d'autoriser la mise sur le marché du Truvada en guise de traitement préventif contre une infection par le VIH, le virus du Sida. Ce médicament serait le premier du genre à être commercialisé. Cet avis est consultatif, mais la FDA s'y fie le plus souvent. Elle donnera sa décision le 15 juin.
Le vote portait sur trois questions. À 19 voix contre 3, le comité a préconisé l'utilisation du Truvada, médicament du laboratoire américain Gilead Sciences, en préventionprévention d'une infection pour les hommes homosexuels séronégatifsséronégatifs. L'utilisation pour les couples hétérosexuels dont l'un des membres est contaminé par le VIH a également été recommandée à une très large majorité (19 voix pour, 2 voix contre et une abstention). Enfin, le scrutin était bien plus serré concernant les personnes à risques, celles n'utilisant pas ou peu régulièrement de préservatifs. Aux 12 voix qui appellent à une prescription pour ces individus, 8 se sont opposées et 2 se sont abstenues.
Le Truvada en prévention du Sida soulève des inquiétudes
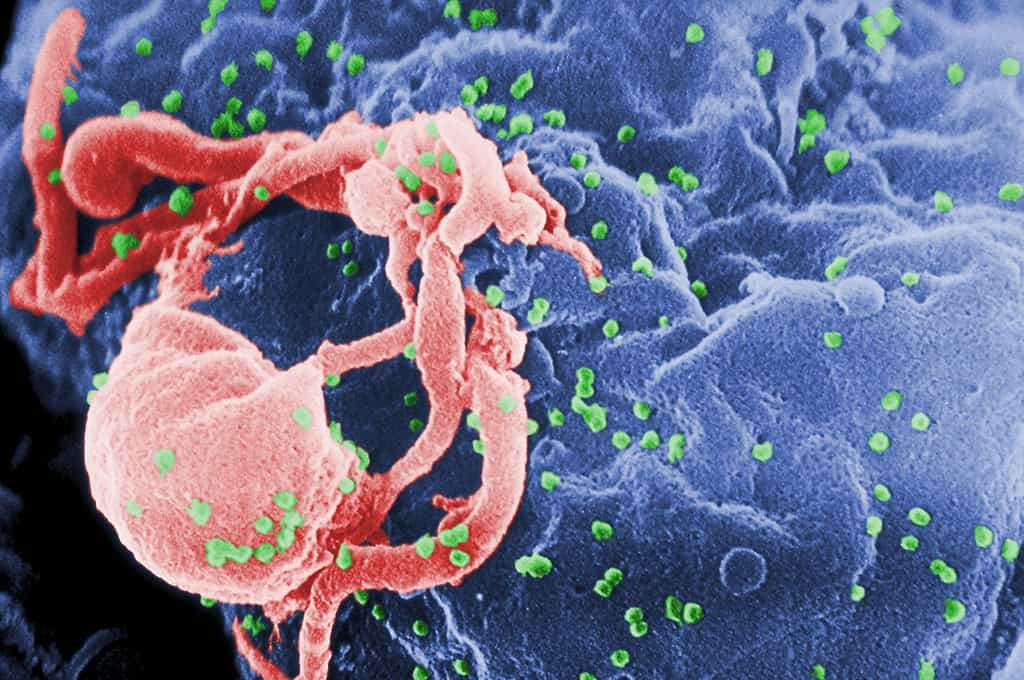
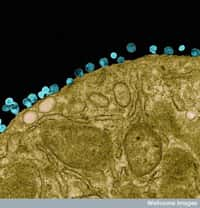
Le Truvada est un traitement déjà utilisé pour les personnes affectées par le virus du Sida ; il peut donc être prescrit dès la décision prise. Il se compose de deux antirétroviraux : l'emtricitabine et le ténofovir. Mais des essais cliniques ont également attesté d'une efficacité préventive. L'un d'entre eux, mené dans six pays entre juillet 2007 et décembre 2009 auprès de 2.499 hommes homosexuelshomosexuels, montrait que le médicament réduisait les risques de contaminationcontamination de 44 %, en sachant que de nombreux sujets ne suivaient pas les recommandations à la lettre. Pour ceux qui ont pris le Truvada tous les jours, comme prévu, les risques d'infection sont tombés de 90 %, mais cela ne concernait que 10 % des participants... Dans une autre étude, le médicament réduisait la probabilité d'être contaminé par le VIH de 73 % dans un couple hétérosexuel dont l'un des membres était séropositif.

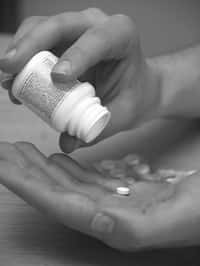
Les traitements préventifs du Sida étaient jusque-là réservés aux essais cliniques. Le Truvada pourrait bientôt être le premier du genre à être commercialisé aux États-Unis. Mais attention à bien respecter les recommandations. © Annapix, StockFreeImages.com
Cependant, certains membres du comité d'experts ont voté contre l'utilisation du Truvada en prévention. Ils déplorent des lacunes dans les données concernant les femmes et les effets rénaux sur les personnes noires. Un essai clinique, mené chez des Sud-Africaines, a dû être arrêté quand les chercheurs se sont aperçus que le traitement n'avait pas plus d'efficacité qu'un placéboplacébo. Une investigation ultérieure révélait que les femmes ne prenaient pas régulièrement le Truvada, ignorant qu'elles étaient à risque.
Lauren Wood, membre du comité d'expert, représentante de l'Institut national du cancer américain, a voté contre parce qu'elle s'inquiète du manque d'informations concernant les dégâts causés par ce genre de traitement sur les reinsreins des personnes noires. Cette partie de la population est la plus exposée au VIH, mais aussi la plus susceptibles de déclarer des insuffisances rénalesinsuffisances rénales à cause des antirétroviraux.
Une alternative crédible pour limiter l'épidémie de VIH
Les scientifiques ne sont pas les seuls à faire part de leur inquiétude. Trente-huit militants d'associations de lutte contre le Sida craignent qu'une mise en circulation du Truvada en guise de traitement préventif fasse beaucoup de dégâts. La posologie étant très stricte et le médicament très coûteux (près de 11.000 € à l'année), ces activistes redoutent une baisse de la vigilance des personnes concernées et que la prise du médicament ne devienne qu'occasionnelle, les weekends par exemple, lorsque le patient sait qu'il est susceptible d'avoir des rapports sexuels. Pour être efficace, le Truvada doit être absorbé quotidiennement et les autres mesures préventives, comme l'utilisation d'un préservatif, s'imposent toujours.
Les experts en sont conscients et invitent à intensifier la politique de sensibilisation pour justifier de la pertinence du médicament. D'autre part, les autres mesures préventives n'ont pas fourni l'effet escompté, il faut trouver des alternatives, et le Truvada en est une crédible. Les scientifiques ont donc pesé les avantages et les risques en toute connaissance de cause, et jugé que le traitement induisait plus de bénéfices. Judith Feinberg, membre du comité et de la faculté de médecine de l'université de Cincinnati, est bien consciente de l'importance des enjeux : « Le pouvoir de nuisancenuisance est phénoménal. Si nous n'avions pas prêté suffisamment d'attention à cela, nous pourrions [...] faire plus de mal que de bien. »
Une recommandation s'impose malgré tout. Les personnes qui recevraient ce traitement préventif ne doivent pas être séropositivesséropositives au VIH au début de la thérapiethérapie, auquel cas on risquerait de favoriser une résistance accrue du virus du Sida aux médicaments. Disposant de toutes ces informations, il revient maintenant à la FDA de trancher. Réponse dans un mois.