La maladie de la "vache folle" est une des encéphalopathies spongiformes animales transmissibles à l'homme. Crédit DR
L'origine des maladies à prion est encore assez mal connue, mais on sait qu'en plus des origines génétiques, la majorité des cas avérés proviennent d'une forme acquise, donc d'une contamination (par la viande ou par un produit médical contaminé) : ce sont les encéphalopathies spongiformes transmissibles (EST). Malgré la rareté des cas (1,5 par million d'habitants et par an pour la maladie de Creutzfeldt-Jakob ou MJC), l'incurabilité rend ces maladies inquiétantes et menaçantes pour la santé publique. Il est donc nécessaire de comprendre comment elles peuvent se transmettre afin d'éviter toute nouvelle catastrophe sanitaire.
Pas besoin de le rappeler, la MJC a causé la panique des consommateurs de viande à la fin des années 1990. Elle se caractérise par une dégénérescence du système nerveux central causée par l'accumulation de prions dans les neurones. Les prions sont des agents pathogènespathogènes atypiques puisque de nature uniquement protéique, à l'inverse des agents pathogènes classiques comme les bactériesbactéries, les virusvirus et les parasitesparasites, qui possèdent en plus de leurs protéinesprotéines un génomegénome composé d'acide nucléiqueacide nucléique.
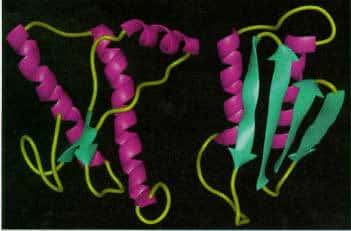
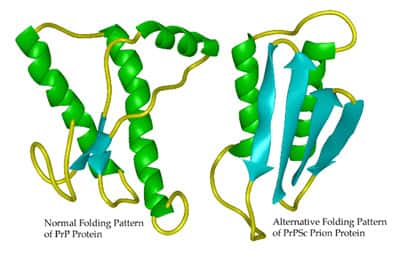
Les prions sont en fait une forme altérée de protéines naturellement synthétisées par l'organisme. On parle de PrPC pour la forme normale, et de PrPSc pour la forme altérée. Si la séquence de la protéine est la même, c'est le repliement de la protéine qui diffère. Le PrPSc est même capable de provoquer le changement de repliement de PrPC en PrPSc, ce qui favorise l'accumulation de PrPSc dans les neurones, et provoque la mort cellulaire. Mais comment un prion provenant d'un bœuf peut-il mener à la modification de la protéine PrPC humaine ?
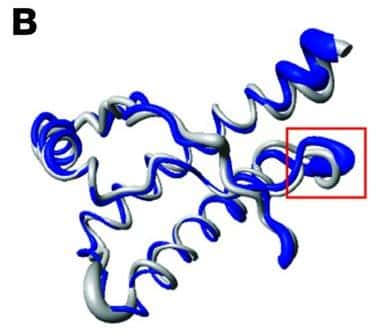
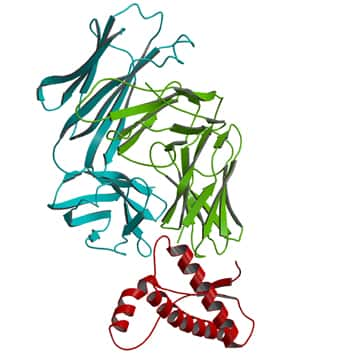
La forme de la boucle β2-α2 de la protéine PrPC influence la transmission de la maladie (en bleu, la PrPC normale, et en gros la PrPC modifiée). © Journal of Clinical Investigation
La boucle β2-α2 influence la transmission
Une équipe de chercheurs de l'Hôpital Universitaire de Zurich, en Suisse, s'est intéressée au mode de transmission inter-espècesespèces des EST. Pour cela, ils ont utilisé le modèle murinmodèle murin pour tester l'efficacité de transmission de la maladie par d'autres mammifèresmammifères. Puisque la séquence de la protéine PrPC est très conservée chez l'ensemble des mammifères, exceptée dans une boucle particulière nommée β2-α2, les chercheurs ont supposé que là était peut-être la clé de la barrière inter-espèce.
Ils ont alors utilisé deux sortes de souris : des souris surexprimant la protéine PrPC ayant une boucle β2-α2 modifiée ou une boucle β2-α2 normale. Ces deux lots de souris ont été soumis à une injection intracérébrale de broyat de cerveaucerveau infectieux de hamster, de cerf, de vachevache ou de mouton, puis ont été suivis pendant plus d'un an afin d'observer les signes d'apparition de l'EST. Alors que la modification de la boucle β2-α2 entraîne une perte de contamination des souris par les prions provenant de vache et de mouton, elle permet au contraire d'augmenter l'efficacité de la contamination des souris par les prions de hamster.
Ces résultats, publiés dans le Journal of Clinical Investigation, indiquent qu'une toute petite partie de la protéine PrPC dicte l'efficacité de la transmission inter-espèce de l'EST. La compréhension d'un tel mécanisme est alors un premier pas vers une meilleure prise en charge d'un problème de santé publique.