au sommaire

L’ESRF à Grenoble. Crédit image : Christian Hendrich (Commons).
L'acétylcholine est le premier neurotransmetteur jamais découvert dès 1907 par JM Gheysen, dans l'ergot du seigle. En 1914, le physiologiste anglais Henry Hallett Dale en collaboration avec le pharmacologiste allemand Otto Loewi parviennent à l'isoler et démontrent que ce composé est un médiateur libéré par le système nerveux parasympathique. On sait aujourd'hui qu'il joue un rôle capital dans le système nerveux central (mémoire et apprentissage), ainsi que dans le système nerveux périphérique.
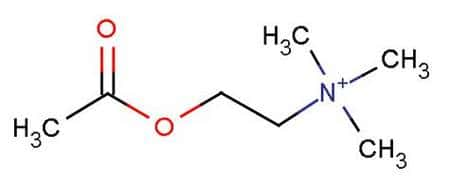
Molécule d’acétylcholine. GNU Free Documentation License.
Ce médiateur est libéré au niveau des synapses des neuronesneurones dits "cholinergiquescholinergiques" du système nerveux périphérique afin de permettre la transmission du flux nerveux d'un neurone au suivant. L'acétylcholinestérase (AChE) ou acétylcholine acétylhydrolase est une enzymeenzyme essentielle à la transmission de ce flux nerveux, qui est aussi à la base des fonctions cognitives (mémoire, jugement...), affectées lors du développement de la maladie d'Alzheimermaladie d'Alzheimer.
C'est la raison pour laquelle plusieurs médicaments anti-Alzheimer (donepezil, rivastigmine, galantamine) inhibent la dégradation de l'acétylcholine, sans toutefois guérir la maladie mais en la stabilisant dans ses formes légères à modérément sévères. Cependant la voie reste prometteuse.
Observer l’acétylcholinestérase en action
L'acétylcholinestérase entraine la dégradation du neurotransmetteur, l'acétylcholine, en coupant la moléculemolécule en deux parties et interrompant la transmission du flux nerveux. Ce processus est appelé clivageclivage enzymatiqueenzymatique. Mais sa duréedurée, une des plus rapides de la nature, excluait jusqu'ici toute observation en détails.
Les chercheurs ont réussi ce tour de force en utilisant une méthode originale en observant la réaction de clivage de l'acétylcholine par absorptionabsorption et diffractiondiffraction des rayons Xrayons X. Mais il leur a fallu, pour cela, surmonter deux difficultés se posant comme autant d'obstacles.
Observer l'enzyme en action impliquait nécessairement de provoquer le démarrage de la réaction. Pour cela, ils ont mis à profit certaines capacités du synchrotron européen ESRF (European Synchrotron Radiation Facility ou Installation Européenne de Rayonnement SynchrotronInstallation Européenne de Rayonnement Synchrotron) de Grenoble, et la capacité de son rayonnement à provoquer des cassures sur les molécules observées. Pour cette expérience, c'est une molécule analogue à l'acétylcholine qui a été utilisée, dont le clivage provoqué au moment choisi par les scientifiques permettait d'en observer le processus à loisir, ainsi que la conformationconformation qu'elle adoptait naturellement après avoir joué son rôle d'"interrupteur moléculaire".
Mais la rapiditérapidité de la réaction, de une à deux millisecondes, excluait toute observation des mécanismes intermédiaires de la cassure. Il s'agit du second obstacle majeur. Pour le surmonter, les chercheurs ont eu recours à des températures cryogéniques, de l'ordre de -120 à -170°C de façon à ralentir le processus et enfin d'en détailler les conformations successivement adoptées par l'acétylcholinestérase au cours du clivage.
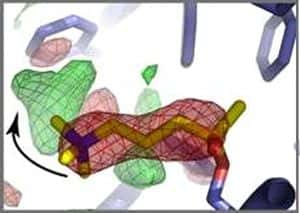
La coupure du neurotransmetteur acétylcholine (jaune) dans le site actif de l'acetylcholinestérase (bleu) provoque la réorientation de la choline, un des deux produits du clivage. Elle passe de la position en rouge à la position en vert (flèche). Crédit : CEA – CNRS – Université Joseph Fourier de Grenoble.
Une porte ouverte vers de nouveaux traitements
Les médicaments utilisés dans le traitement de l'Alzheimer cités ci-dessus agissent essentiellement en piégeant leur cible dans une conformation bien particulière, mais leurs effets restent très modestes, et seulement dans 10 % des cas. La connaissance de l'ensemble des conformations pouvant être adoptées par l'enzyme peut être d'un grand secours dans la mise au point rationnelle de molécules plus efficaces, et conduire à une deuxième génération de médicaments anti-Alzheimer.
Cette étude est en cours de publication dans les PNAS (Proceedings of the National Academy of Sciences) sous le titre "Shoot-and-traptrap: use of specific X-ray damage to study structural protein dynamics by temperature-controlled cryo-crystallography".