au sommaire

Les douleurs intenses viennent peut-être de trouver leur maître : un peptide issu d'un cône (Conus victoriae) et nommé α-conotoxine cVc1.1. Crédit DR
Les cônes et leurs très belles coquilles attirent le plongeur et le collectionneur de coquillages mais les connaisseurs se méfient de ce gastéropodegastéropode, au poison dangereux. Les scientifiques, eux, sont intéressés par le veninvenin, contenu dans la sorte de dent qui sert de harpon à l'animal pour chasser ses proies, et composé de conotoxines.
En effet, les α-conotoxines sont connues pour avoir une action antidouleur, comparable à celle de la morphine, avec l'avantage de ne pas provoquer d'accoutumance. Elles agissent comme des inhibiteurs des récepteurs nicotiniques de l’acétylcholine au niveau des nerfs et des muscles.
Les médecins cherchent depuis longtemps à utiliser les α-conotoxines comme traitement analgésique mais leur utilisation est pour l'instant très modeste. Son administration est compliquée puisque la moléculemolécule doit être directement introduite dans la moelle épinière des patients.
Les chercheurs de l'Institute for Molecular Bioscience à l'Université du Queensland en Australie ont publié dans le journal Angewandte Chemie International Edition des résultats qui promettent à l'α-conotoxine de beaux jours devant elle. Ils ont en effet réussi à montrer l'efficacité d'un peptide, dérivé de l'α-conotoxine, utilisable par simple voie orale. Leur idée a été de mofifier la structure de la molécule pour la rendre, en quelque sorte, plus solidesolide.
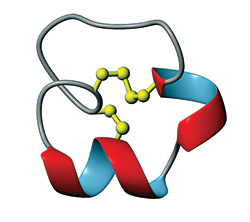
L'α-conotoxine circularisée grâce à l'ajout de quelques acides aminés. En jaune sont représentés les ponts disulfures au sein de la protéine. © Angewandte Chemie International Edition
Une arme possible contre les douleurs neuropathiques
La stratégie a consisté en la circularisation du peptide, en rassemblant les deux extrémités de la protéine. Habituellement, les peptidespeptides ne sont pas ou très peu utilisés comme médicaments par voie orale car ils sont très instables et dégradés dans le système digestif avant d'avoir pu jouer leur rôle. Le fait que la protéine soit circularisée la rend résistante aux exopeptidases (enzymesenzymes qui s'attaquent aux extrémités protéiques) mais aussi aux endopeptidases (enzymes qui clivent les liaisons peptidiquesliaisons peptidiques internes) grâce au renforcement des liaisons hydrogèneliaisons hydrogène internes.
Les deux extrémités d'une protéine sont fréquemment localisées assez proches l'une de l'autre : l'ajout de quelques acides aminésacides aminés suffit donc à joindre les deux bouts. Ici, le lien entre les deux extrémités est composé de seulement six acides aminés, dont 2 alaninesalanines et 4 glycinesglycines. Il a été choisi pour la faible réactivité de ces deux acides aminés. De plus, son faible coût et sa facilité d'identification par résonance magnétique nucléairerésonance magnétique nucléaire (RMN), constituaient les autres avantages.
Le peptide ainsi circularisé a été testé sur des rats, chez qui la molécule a été administrée oralement. L'efficacité antidouleur de l'α-conotoxine circularisée est bluffante : elle est aussi efficace que le médicament habituellement donné dans les cas de forte douleurdouleur (la gabapentinegabapentine) et il suffit d'administrer un centième de la dose habituelle !
Son petit nom, l'α-conotoxine cVc1.1, est à retenir. Ce peptide porteporte en lui l'espoir des patients atteints de douleurs neuropathiques, c'est-à-dire dues à des lésions du système nerveux, permanentes et difficiles à supporter. Pour l'heure, ces patients sont privés de traitements réellement efficaces.