au sommaire
Les dents sont composées des structures minérales les plus solidessolides du corps humain. La surface blanche est constituée d'émail, reposant sur une structure en dentine (ivoire) qui repose elle-même sur la pulpe innervée et vascularisée reliée à la gencive. Cette structure complexe rend les dents très résistantes. Mais d'après les dentistes, les dents seraient encore plus résistantes en présence de fluorfluor ! Est-ce vraiment avéré ? Des chercheurs se sont penchés depuis longtemps sur le problème et ont fini par comprendre la chimiechimie de la surface dentaire.
L'émail des dents est composé d'un réseau de cristaux d'hydroxyapatite de calciumcalcium, qui confère à la dent un bouclier résistant. La surface de l'émail dentaire peut être attaquée par fluorisation et former la fluorapatite. Celle-ci est connue pour être plus résistante aux acidesacides que l'hydroxyapatite, et donc considérée comme responsable de la résistancerésistance des dents aux caries.
La fluorisation s’effectue en surface de l’émail
Le but des scientifiques de l'université de la Sarre en Allemagne était de comprendre les mécanismes intimes de la fluorisation, et plus particulièrement d'évaluer avec précision l'épaisseur de la couche fluorée à la surface des dents.
Afin d'éviter les mesures directes sur des vraies dents qui possèdent chacune leurs propres caractéristiques et qui avaient fait l'objet d'études contradictoires, les chercheurs ont utilisé une couche synthétique d'hydroxyapatite de calcium et ont analysé l'effet de son exposition au fluor. Les mesures ont été réalisées grâce à la spectroscopie photoélectronique par rayons Xrayons X (XPSXPS), un parfait outil pour analyser les profils de profondeur des éléments, couche par couche à l'échelle du nanomètrenanomètre.
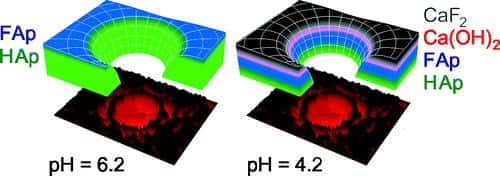
Les couches d'émail fluorées (noir et bleu) sont plus épaisses à pH acide. FAp : fluorapatite ; HAp : hydroxyapatite. © Langmuir
D'un point de vue qualitatif, les chercheurs ont montré les mêmes mécanismes que ceux décrits par de précédentes études. En présence d'un agent fluoré neutre (pH 6,2), proche du pH naturel de la bouche, la fluorisation consiste en un simple échange du groupement OH de l'hydroxyapatite par un atomeatome de fluor. En présence d'un agent fluoré plus acide (pH 4,2), la fluorisation ne se contente plus d'un simple remplacement d'atomes : tout un processus chimique intervient, formant trois couches de fluorisation successives.
La couche fluorée ne mesurerait que 6 nanomètres !
Mais lorsque l'on analyse quantitativement les épaisseurs des différentes couches, la différence est de taille ! Alors que la fluorisation acide avait été mesurée sur une profondeur de 4,5 micromètresmicromètres sur un émail humain, elle n'est que de 77 nanomètres dans les expériences réalisées par les scientifiques allemands, soit 60 fois moins. La couche fluorée lors de la fluorisation à un pH neutre a été mesurée à 6 nanomètres, soit 10 fois moins que précédemment.
On peut alors se demander qui a raison... Néanmoins, les auteurs de l'article publié dans la revue Langmuir indiquent que « puisque les ionsions fluor possèdent seulement une profondeur de pénétration faible, les ions fluor doivent être continuellement administrés (par exemple par l'utilisation de dentifrices ou de bains de bouche fluorés) ». Mais d'un autre côté, l'usure quotidienne des dents a été estimée à 3 nanomètres. Selon eux, il est donc logique de « se poser la question de savoir si la couche de 6 nanomètres de fluorapatite agit réellement comme une couche protectrice ». La suite au prochain numéro...