au sommaire
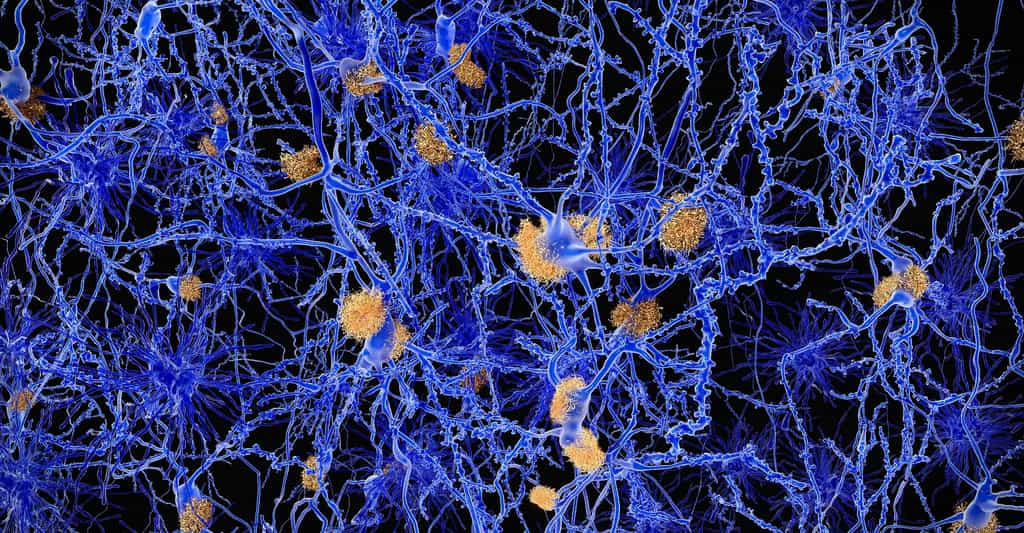
Présents dans le cerveau, les prions sont des protéines normales qui devraient être inoffensives, mais elles deviennent infectieuses à cause d'un mauvais repliement. En contact avec d'autres protéines, le prion peut imposer sa structure aux autres protéines, qui s'accumulent en amas protéiques créant des dommages aux cellules et au cerveau.
Les prions causent les encéphalopathies spongiformes, qui sont incurables : maladie de la vache folle, maladie de Creutzfeldt-Jakob ou kuru (maladie identifiée en Nouvelle-Guinée). Mais le mauvais repliement des protéines et la formation d'amas protéiques sont des mécanismes qui se retrouvent dans d'autres troubles neurodégénératifs comme les maladies d'Alzheimer et de ParkinsonParkinson.
Comme les prions mal repliés ne peuvent pas être inactivés par la chaleurchaleur ni les radiations, ils peuvent se transmettre à d'autres patients s'ils entrent en contact avec des instruments chirurgicaux. Or, il a été montré que la maladie d’Alzheimer peut se transmettre lors d'opérations chirurgicales, ce qui suggère une maladie proche d'une maladie à prions.
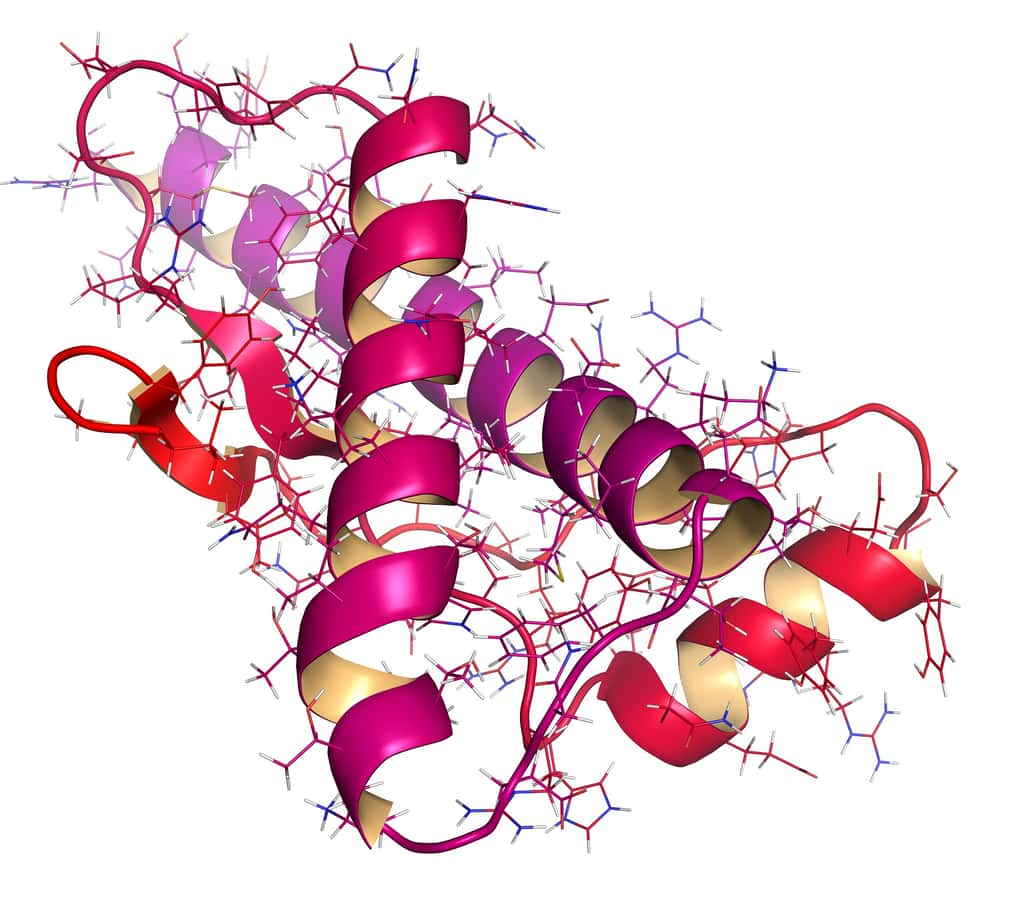
La protéine de prion (PrP), lorsqu’elle est mal repliée, se comporte comme un agent infectieux. © molekuul_be, Shutterstock
Le cuivre responsable du mauvais repliement du prion
Dans une recherche parue dans la revue Science Advances, des chercheurs de l'université d'État de l'Iowa ont montré pour la première fois comment, au niveau moléculaire, des ionsions cuivrecuivre peuvent causer un mauvais repliement des prions. En effet, le lien entre le cuivre et les prions était déjà connu, mais sans que le mécanisme exact soit identifié.
La protéine PrP impliquée dans les encéphalopathies spongiformes est capable de se lier à des métauxmétaux : son extrémité N-terminale contient quatre copies d'une séquence qui s'associe à différents ions divalents, comme Cu2+, Ni2+ et Mn2+. Grâce à une technique d'imagerie très puissante, les chercheurs ont montré que le mauvais repliement de PrP commence lorsque des ions cuivre se lient à cette extrémité protéique.
Les prions mal repliés collent entre eux 900 fois mieux que les protéines PrP normales. Chez la souris, les chercheurs ont aussi montré que ces changements induits par le cuivre sont associés à l'inflammationinflammation et à des dommages dans le tissu nerveux.
Cette nouvelle étude établit donc un lien direct entre l'exposition au cuivre et la neurotoxicité de la protéine prion. Elle suggère qu'un excès d'ions cuivre peut être à l'origine d'une maladie neurodégénérativemaladie neurodégénérative.