au sommaire
L'acier, au sens strict, est une solution solide de carbone (moins de 2 %) dans le fer susceptible de durcir par trempe. Découvrez les secrets de fabrication de l'acier et ses alliages.

Quels sont les secrets de fabrication de l'acier ? Quels sont ses alliages ? Ici, des matériaux de construction en fer. © Inozemtsev Konstantin, Shutterstock
Le terme « fer », que l'on emploie de nos jours, signifie en fait « acier » : il ne s'agit pratiquement jamais de « fer pur » ! Il faut admettre que l'usage en a fait des synonymes alors qu'à l'origine, ces termes ne désignent pas le même produit. Pourtant, même les chimistes et les métallurgistes parlent souvent de « fer » quand il s'agit, en réalité, d'« acier ».
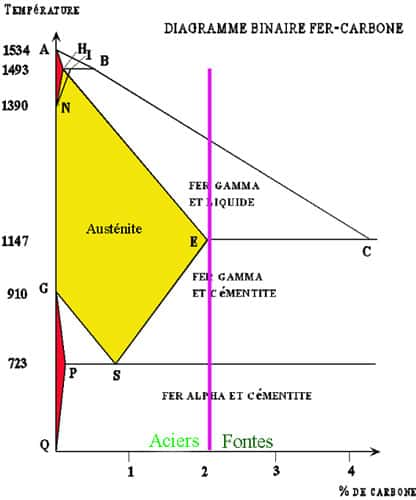
Diagramme binaire fer-carbone simplifié.
Concentration de carbone dans l'acier : le diagramme binaire fer-carbone
Le diagramme binairediagramme binaire très simplifié ci-dessus montre que si la concentration de carbone dépasse 2 %, il y a formation de l'eutectiqueeutectique qui contient 4,3 % de carbone, ce constituant (parfois nommé « lédéburite ») étant caractéristique des fontesfontes. Le domaine des aciers est limité à moins de 2 %, moins encore si l'on considère un possible refroidissement rapide qui ramènerait le point E sur la gauche à 1,75 %. Il a aussi moins de 0,05 % de soufresoufre et phosphorephosphore qui sont des impuretés indésirables.
Quelques explications succinctes à propos du diagramme ci-dessus :
- A (0 ; 1534) : PF fer 100 %
- B (0,51 ; 1493 ou 1495) : palier péritectique fer + liquide <-> fer γ
- C (4,3 ; 1147 ou 48) : C'est le point de la fonte blanche eutectique.
- La ligne ABC représente le liquidusliquidus, ceci signifie que dans toute la partie inférieure du diagramme on est en solution solide.
- E (2,06 ; 1147 ou 48) point du palier eutectique à 1147 ou 48 degrés. Si le refroidissement est très rapide ce point peut se déplacer vers la gauche jusqu'à 1,75 % de carbone, ceci limite la zone acier.
- G (0 ; 910) P (0,02 ; 723 ou 727) et Q (0 ; 500) limitent le triangle GPQ du fer α ou ferrite α.
- H (0,1 ; 1493 ou 95) point de solubilité maximum de C dans le fer δ entre 0,07 et 0,1 %.
- N (0 ; 1390)
- Le triangle AHN délimite l'existence du fer δ ou ferrite δ.
- S (0,77 ; 723 ou 727) la ligne 723 ou 727 est l'eutectoïde, fer γ <--> fer α + cémentitecémentite.
Les températures diffèrent un peu selon qu'on a de la cémentite ou du graphitegraphite.
Austénite, perlite, ferrite, cémentite et martensite
Il y a plusieurs solutions solides par insertion de carbone dans le fer (par opposition à solution par substitution) à savoir :
- L'austénite : solution de carbone dans le fer γ (gamma). Cristallise dans le système cubiquesystème cubique faces centrées CFCCFC. La présence de nickelnickel dans l'acier stabilise cette phase (donc augmente sa surface sur le diagramme) à tel point que si la teneur en nickel dépasse 18 %, on a de l'austénite jusqu'à température ambiante ! Si on refroidit de l'austénite à vitessevitesse moyenne, on obtient de la troosite très dure avec des lamelles de ferrite et de la cémentite. Si on la refroidit plus vite, on a de la bainite en aiguilles et si on la refroidit très vite, on obtient de la martensite.
- La perliteperlite : eutectoïde formé par le fer et le carbone à 723 degrés.
- La ferrite α et δ : solution de carbone dans le fer qui cristallise dans le système cubique centré. Ces deux ferrites cristallisent dans le système cubique centré CC. Le chromechrome dans l'acier stabilise la phase alpha.
- La cémentite, de formule Fe3C, est formée de 12 atomesatomes de fer pour 4 de carbone ; sa structure est orthorhombique et elle a la propriété de se décomposer avant de fondre, ce qui empêche de connaître toute la partie à droite du point C dans le diagramme binaire.
- La martensite : constituant dur des aciers qui cristallise en plaquettesplaquettes ou en aiguilles et qui prend naissance par refroidissement brutal de l'austénite qui empêche une diffusiondiffusion du carbone dans le fer ; la martensite est très dure mais très fragile.
Paliers isothermes : péritectique, eutectique et eutectoïde
Les paliers isothermes du diagramme binaire : chaque palier correspond à la coexistence de 3 phases en équilibre thermodynamiquethermodynamique à température constante (règle des phases de Gibbs).
- Le péritectique à 1.495 °C : on est en présence d'une solution de fer liquide à 0,53 % de carbone en poids de C, et de 2 solutions solides de la ferrite deltadelta à 0,09 % de C et de l'austénite à 0,017 % de C.
- L'eutectique à 1.148 °C : les 3 phases sont les suivantes : une solution de fer liquide à 4,26 % de C et deux phases solides, de l'austénite à 2,11 % de C et du graphite ou de la cémentite.
- L'eutectoïde à 727 °C : c'est l'équilibre entre 3 phases solides : la ferrite alpha à 0,021 % de C, l'austénite à 0,77 % de C (composition de l'eutectoïde) et la cémentite ou le graphite. À l'état solideétat solide, c'est la réaction isotherme de l'eutectoïde qui régit les transformations de l'austénite. La transformation de l'austénite commence par la ferrite si le pourcentage de carbone est inférieur à 0,77 % et par la cémentite ou le graphite si le pourcentage de carbone est compris entre 0,77 et 2,11 %.
À 727 °C, ces réactions sont interrompues par la transformation de l'austénite à 0,77 % en ferrite à 0,021 % et la cémentite ou le graphite.
En dessous de 727 °C, on trouve un domaine biphasé de ferrite et de cémentite mais la solubilité du C dans la ferrite diminue quand la température descend et on observe une décomposition de la ferrite, sursaturée en C, par précipitation de cémentite selon la réaction :
Quelques détails autour de 1.495 degrés : le point péritectique détermine la transformation des phases lors de la solidificationsolidification des aciers dont les pourcentages en poids de carbone sont compris entre 0,09 et 0,53 %.
En abaissant la température depuis le point de solidification, on a d'abord : liquide -> fer delta + liquide.
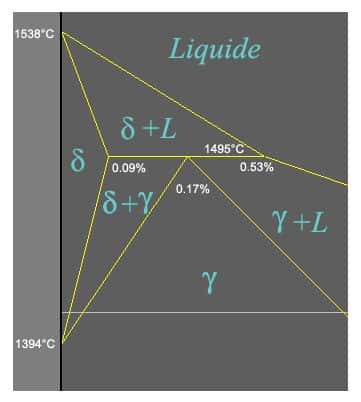
Zoom sur 1.495 degrés.
Lorsque le pourcentage de carbone du fer liquide atteint 0,53 à 1.495 degrés, on a 3 phases : la solution de fer-carbone à 0,53 %, la ferrite delta solide et l'austénite solide. À ce moment il n'y a plus de degré de liberté (3 phases à P fixée -> TT fixée aussi !).
À la fin de la réaction péritectique, les alliages à teneur en carbone comprise entre 0,09 et 0,17 % sont composés d'un mélange de ferrite delta et d'austénite alors que ceux dont la teneur en carbone est comprise entre 0,17 et 0,53 % sont composés d'austénite et de fer liquide. L'alliage à 0,17 % de carbone est entièrement austénitique.
Carbone dans le réseau cristallin CFC et CC
Découvrez à présent comment le carbone se place dans le réseau cristallinréseau cristallin CFC (Cubique faces centrées) et CC (Cubique centré).
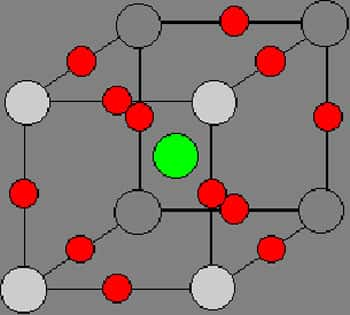
Fer CC et carbone.
Le carbone se place sur les arêtes des cubes des mailles élémentaires des structures de l'acier, que ce soit cubique centré ou cubique faces centrées (voir les deux schémas ci-dessus et ci-dessous).
Fer CFC et carbone.
On peut calculer la compacité d'une maille, le déplacement contraint que doivent effectuer les atomes de fer pour laisser la place et donc encore le remplissage de carbone dans la maille d'acier.
La compacité d'une maille de fer Cubique Centrée sera d'environ 68 %. La compacité d'une maille de fer CFC sera d'environ 74 %. La maille CFC est plus compacte que la maille CC. La diffusion du carbone dans le fer se fera au niveau de l'arête d'une maille. Un atome de carbone a un diamètre = 154 pm. Pour une maille CC, chaque atome de fer du côté de la maille devra se déplacer de δ = 39% environ. Pour une maille CFC on aura un déplacement de l'atome de fer de δ = 15% environ. Le fer α a un coefficient de remplissage inférieur (0.68) - il y a donc plus de « vide » - à celui du fer γ (0.74) mais l'insertion du carbone y est plus difficile - les atomes doivent s'y « déplacer » davantage.
Point de Curie à 769 °C
Considérons encore quelques points particuliers de l'acier, notamment le point de Curie à 769 °C (magnétismemagnétisme et température) :
- Entre 0 et 769 °C, on a du fer alpha, ferromagnétiqueferromagnétique, cubique centré
- Entre 769 et 910 °C, on a du fer que l'on appelait jadis « beta » (dénomination qui n'existe plus), mais entre ces 2 températures, s'il n'y a pas de changement structurel (il est toujours cubique centré), il devient en revanche paramagnétiqueparamagnétique.
- Entre 910 et 1.390 °C, on a du fer gamma, cubique faces centrées et paramagnétique.
- Entre 1.390 et 1.536 °C, on a du fer delta, de nouveau cubique centré mais toujours paramagnétique.
- Au-dessus de 1.536 °C, le fer est liquide.
À présent, découvrez-en plus sur l'évolution du volumevolume spécifique en fonction de la température à pression atmosphériquepression atmosphérique (Patm) :
- Entre 0 et 910 °C, le volume spécifique passe de 0,1270 cm3.g-1 à 0,1321 de façon continue et rectiligne.
- Puis, une brusque contraction apparaît au changement de structure à 910 °C avec un volume spécifique qui diminue fortement et brutalement à cette température (CC -> CFC) passant à 0,1307, soit une diminution de 1,03 %.
- Puis, il remonte à 0,1351 jusqu'à 1.390 °C, où il y a le deuxième changement de structure (CFC -> CC) avec une augmentation de volume brusque à 1.390 °C, mais pas aussi importante que la première variation, et le volume spécifique passe à 0,1358 soit une augmentation de 0,54 %.
- Puis, il augmente jusqu'à 0,1372 à 1.536 °C, ce qui est normal.
Mais au moment du passage à l'état liquideétat liquide une brusque dilatationdilatation apparaît avec un volume spécifique qui passe brusquement à 0,1421 cm3 g-1 soit une dilatation de 3,58 % à la fusionfusion.
Taille des grains d'austénite et vitesse de refroidissement
La taille des grains d'austénite varie avec plusieurs facteurs, dont la température : une température de chauffage plus importante donnera des grains plus gros de manière générale, mais ce n'est pas toujours le cas suivant la composition de l'acier et si l'évolution du diamètre des grains n'est pas linéaire avec la température à Patm, ceci peut avoir une grande importance pour le laminagelaminage à chaud de l'acier, par exemple.
Lorsque la vitesse de refroidissement de l'austénite est plus grande qu'une certaine valeur critique (entre 100 et 1.000 °C / sec selon la teneur en carbone de l'acier), la ferrite, la perlite et la bainite obtenues lors du refroidissement lent sont alors remplacées par de la martensite en lattes ou en aiguilles selon la teneur en carbone.

Four Bessemer.
Fabrication de l'acier : le procédé Bessemer
Pour effectuer une décarburationdécarburation de la fonte, on doit oxyder le carbone contenu dans cette dernière. Bessemer créa le convertisseur qui porteporte son nom en 1855. Bessemer mis son procédé en applicationapplication dans ses usines de Sheffield. Ce procédé utilisait un four cornu qui pouvait être incliné pour le déchargement. De grandes quantités d'airair étaient insufflées dans la massemasse de fonte fondue. Pour cela, une puissante soufflerie était nécessaire. L'oxygèneoxygène se combinait alors chimiquement avec le carbone.
Bessemer est le premier à faire monter la température assez haut pour convertir la fonte en acier ; il faut en effet atteindre 1.600 degrés. Son four est construit en réfractaireréfractaire de silicesilice, acideacide, et la combustioncombustion carbone et silice entraîne une augmentation suffisante de température pour la transformation recherchée.
En France, le premier convertisseur a été construit en Gironde, à Saint-Seurin-sur-l'Isle, mais (il y a toujours un mais) l'acidité de la silice nécessitait l'utilisation d'une fonte sans phosphore, c'est-à-dire très pure et ceci empêchait toute utilisation du mineraiminerai lorrain !
Il fallut attendre 1877 et Thomas découvrit la possibilité d'éliminer le phosphore en créant un four dont le revêtement est basique et non plus siliceux. En utilisant de la chauxchaux, il obtint un acier doux qui suscitait la méfiance... au point qu'Eiffel construira sa tour en fer puddlé et non en acier !
1900, enfin, est la première année où l'utilisation de l'acier dépasse celle du fer puddlé...
1930 voit l'avènement de l'aciérie électrique, utilisée pour la récupération des ferrailles. Ces dernières sont introduites dans le four et les électrodesélectrodes forment des arcs puissants pour les fondre. Ce procédé est très consommateur d'énergieénergie ; il pose certains problèmes à la Chine qui n'a pas encore de distribution suffisante d'électricité pour sa très forte demande en acier. En revanche, il permet un recyclagerecyclage très important des fers et aciers à tous les niveaux, ce qui présente, globalement, un bilan écologique très favorable.
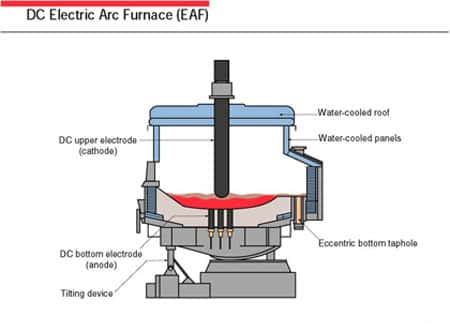
Four électrique à arc. © energymanagertraining.com
En 1950 fut inventé le convertisseur à l'oxygène pur. L'oxydationoxydation est très rapide par rencontre de l'oxygène pur avec le métalmétal en fusion. Les déchetsdéchets sont le laitier de silice, l'oxyde de manganèsemanganèse et un peu d'oxydes ferreux et ferriques qui surnagent. Les gazgaz sont éliminés à mesure.
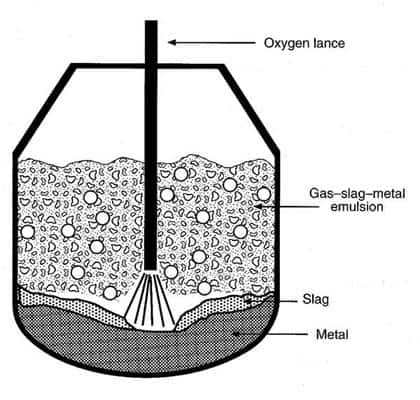
Principe de fonctionnement du procédé Basic oxygen steelmaking (BOS), ou procédé LD en français.
Le tableau ci-dessous indique les pourcentages d'impuretés que l'on cherche à éliminer de la fonte pour obtenir un bon acier ainsi que le résultat obtenu (indicatif).
| --- | % C | % Mn | % Si | % P | % S | PF en °C |
| Fonte liquide | 4,7 | 0,23 | 0,26 | 0,08 | 0,02 | 1.370 |
| Acier liquide | 0,05 | 0,1 | 0 | 0,015 | 0,015 | 1.670 |
Les procédés de réduction directe sont utilisés fréquemment ; le schéma ci-dessous vous en donne le principe général.
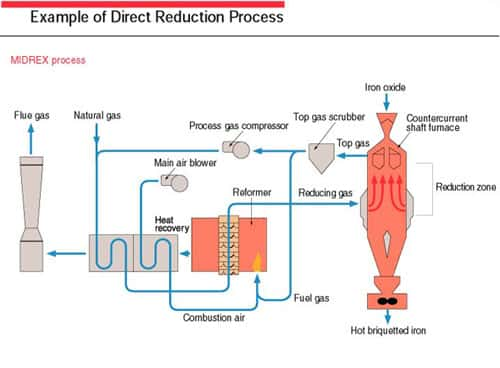
Procédé de réduction directe. © energymanagertraining.com
On utilise encore le four à induction pour fabriquer certains aciers très particuliers ou très purs et pour de relativement petites quantités.
Le schéma ci-dessous est un résumé général de la production des fers et aciers.
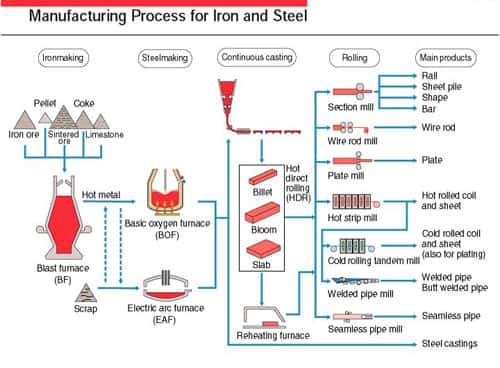
Schéma de la production des fers et aciers. © energymanagertraining.com
Figures de Widmanstätten
Les figures de Widmanstätten portent le nom du savant français qui les a décrites pour la première fois en 1808 et sont redoutées de ceux qui travaillent avec des aciers. Ces structures apparaissent chaque fois que l'acier est chauffé à haute température (1.000 à 1.100 degrés, donc en phase γ) pendant un temps assez long pour que les grains grossissent bien.

Figures de Widmanstätten sur acier.
Le refroidissement est brutal, jusqu'à 700 degrés, et ensuite normal pour que la ferrite se développe dans le plan 111 de l'austénite plutôt qu'aux joints des grains. La déshomogénéisation due au chauffage à haute température favoriserait la germination orientée de la ferrite.

Figures de Widmanstätten.
Ces structures se forment quelle que soit la teneur en carbone de l'acier mais sont plus difficiles à obtenir si celle-ci est faible. Elles entraînent (pour l'acier) une duretédureté accrue mais aussi une fragilité plus grande et une corrosioncorrosion plus importante.