au sommaire
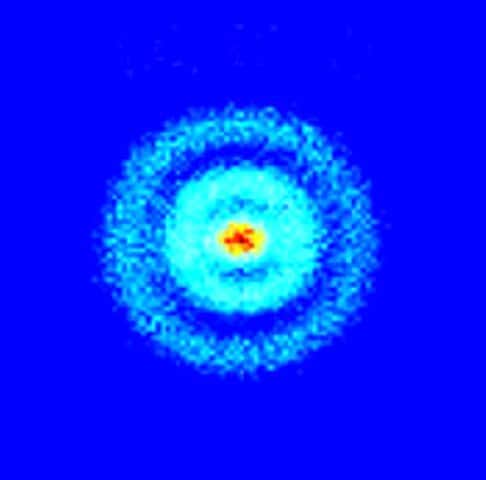
Voici l'image obtenue sur un écran à l'aide de capteurs dans le cadre de l'expérience de microscopie de photoïonisation avec un atome d'hydrogène. On voit clairement les oscillations dans les densités de probabilité de présence correspondant à des orbitales atomiques. © Stodolna et al., Physical Review Letters
Le physicienphysicien allemand Werner Heisenberg a découvert la formulation matricielle de la mécanique quantique en rejetant le concept de trajectoire dans l'espace et dans le temps pour un électron dans un atome. Il affirmait que l'on ne pouvait pas observer une telle trajectoire... parce qu'elle n'existait pas. Peu de temps après, Erwin SchrödingerErwin Schrödinger pensa avoir démontré que son jeune collègue se trompait. Il avançait qu'il était possible de retrouver les équations découvertes par Heisenberg, Max BornMax Born et Pascual Jordan, en utilisant des images intelligibles d'ondes de densité de charge dans l'espace et dans le temps. Schrödinger ne faisait que développer les idées contenues en germegerme dans la mécanique ondulatoire de Louis de BroglieLouis de Broglie.
Du moins, c'est ce qu'il croyait, mais il était pourtant bien conscient que les ondes associées aux particules qu'il introduisait avec sa fameuse équation n'étaient pas vraiment des ondes dans l'espace et le temps. Ainsi, on devait les concevoir comme des ondes se propageant dans un espace de configuration à 3N dimensions, pour un groupe de N électrons dans un atomeatome donné. Toutefois, dans le cas de l'unique électron d'un atome d’hydrogène, l'équation de Schrödingeréquation de Schrödinger gouverne bel et bien une onde que l'on peut se représenter dans l'espace et dans le temps.
Une vidéo du congrès de Solvay de 1927, prise par Irving Langmuir. Lors de cette conférence, plusieurs des plus beaux textes de l'histoire des sciences furent présentés. Portant sur l'état de la théorie quantique à l'époque, ils marquent en quelque sorte la naissance de l'interprétation orthodoxe de la mécanique quantique. Ces écrits montrent que les pères fondateurs ne s’accordaient pas entre eux. Schrödinger, Einstein et de Broglie n'avaient pas la même vision que Bohr, Pauli, Heisenberg et Born. On peut trouver les rapports du congrès dans une publication complète sur arxiv (voir lien en fin d'article). © Nancy Thorndike Greenspan, YouTube
Densité de probabilité de présence des électrons dans un atome
Les travaux de Schrödinger semblaient montrer que les électrons dans un atome pouvaient être vus comme des paquetspaquets d'ondes en mouvementmouvement sur une trajectoire, et que leurs orbitesorbites dans l'atome de Bohratome de Bohr seraient des zones de ventres analogues à celles des cordes et des membranes vibrantes. Or, peu de temps après, ils furent réinterprétés d'une tout autre façon par Max Born.
Le physicien, qui n'est autre que le grand-père d'Olivia Newton-John, affirma que les images intuitives que Schrödinger donnait des phénomènes quantiques étaient intenables. La fameuse fonction d'onde qu'il avait découverte ne donnait pas une densité de charge quand on l'élevait au carré, mais bien une densité de probabilité, celle, par exemple, de trouver un électron en un point donné dans l'atome d'hydrogènehydrogène.
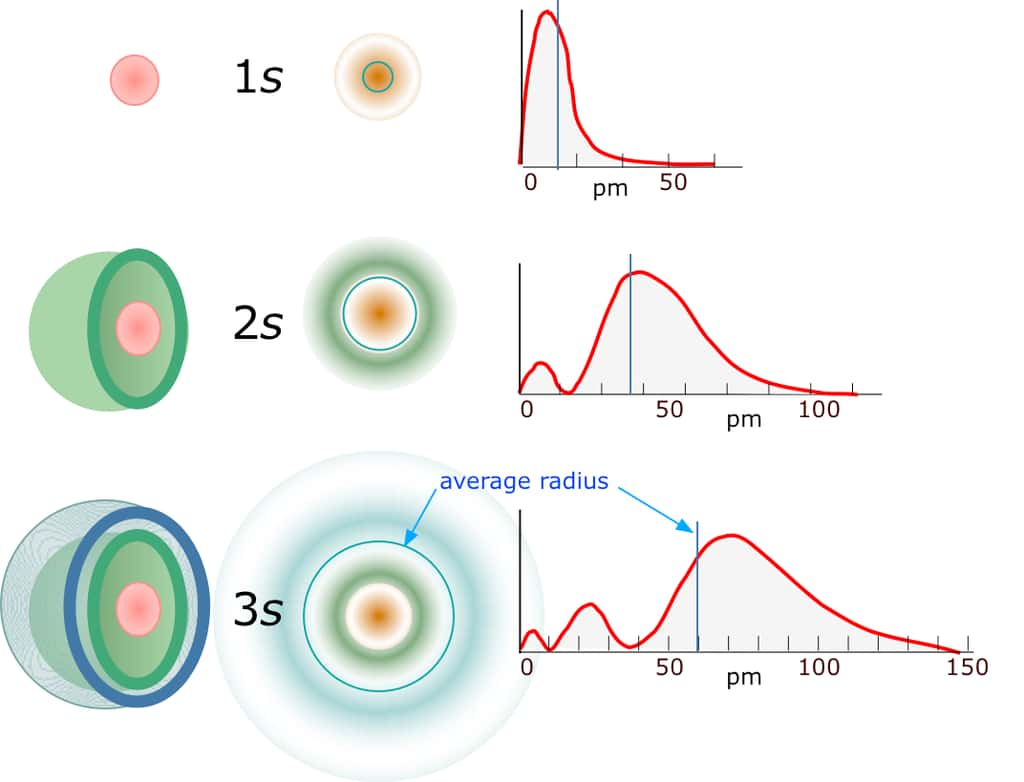
Sur ce schéma, on a représenté des densités de probabilité de présence simple pour un électron dans un atome d'hydrogène (en ordonnée) en fonction de la distance au noyau (en picomètres). Elles constituent des zones où elles sont maximales, et s’organisent en une à trois « coquilles emboîtées ». Ces densités de probabilité de présence ont une forme analogue à celle des amplitudes d'ondes stationnaires avec des nœuds et des ventres, dans le cas des cordes et membranes vibrantes. © Zeably Inc
La microscopie de photoïonisation, une idée russe
Aucune expérience n'est venue contredire le point de vue de Born (ni celui d'Heisenberg), qui fait partie depuis longtemps de ce que l'on appelle l'interprétation de Copenhagueinterprétation de Copenhague de la mécanique quantique. Il est tout de même possible d'observer et de cartographier les zones où la probabilité de trouver un électron est la plus forte dans un atome d'hydrogène, dans certaines circonstances. C'est ce que vient de prouver un groupe international de physiciens en utilisant la méthode dite de microscopie de photoïonisation.
L'idée de la méthode de microscopie de photoïonisation est ancienne. Elle a d'abord été proposée et étudiée théoriquement par des physiciens russes, Fabrikant, Demkov, Kondratovich et Ostrovsky, voilà environ 30 ans. Depuis, elle a fait l'objet de plusieurs travaux expérimentaux et théoriques, notamment en France.
Les chercheurs expliquent dans leur article, déposé sur arxiv, qu'ils ont commencé par produire un faisceau d'atomes d'hydrogène qu'ils ont plongés dans un champ électriquechamp électrique. En utilisant des faisceaux laser, ils pouvaient exciter ces atomes pour former des variantes des atomes de Rydberg et les ioniser à volonté. Les électrons de ces atomes sont sur des orbitalesorbitales atomiques que l'on appelle des états quasi liés de Stark. Ces états sont intéressants puisque, comme dans le cas des électrons dans un atome de Rydberg, ils sont proches de ceux qui décriraient des orbitales classiques, mais aussi parce qu'ils permettent justement de former une image directe des ventres de la fonction d'onde des électrons dans l'expérience.
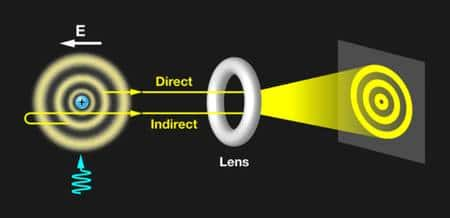
Le schéma de l'expérience des physiciens. Un atome d'hydrogène plongé dans un champ électrique E (à gauche) possède des orbitales atomiques similaires à celles des atomes de Rydberg quand on l'excite avec un laser (flèche bleue). En ionisant les électrons de paquets d'atomes d'hydrogène dans ces orbitales, on produit un flux électronique (symbolisé par les flèches jaunes). Ce flux peut être modifié par une lentille (lens) pour former une image agrandie. Dans ce cas précis, l'image donne directement une représentation des densités de probabilité de présence des électrons dans les orbitales atomiques, avant ionisation. © Alan Stonebraker, APS
Une microscopie qui marche aussi avec l'atome d'hélium
En libérant les électrons des atomes dans cette situation expérimentale, c'est-à-dire en ionisant les atomes d'hydrogène avec des faisceaux laserlaser, on crée une population d'électrons accélérés par le champ électrique, dont les trajectoires sont en relation directe avec la position des ventres de la fonction d'onde. Les faisceaux d'électrons produits interfèrent alors et se comportent un peu comme ceux d'un microscope électronique. Une lentillelentille électrostatiqueélectrostatique permet de former une image sur un écran qui sert de capteurcapteur. Cette image n'est autre que celle, directe et agrandie, des ventres de la fonction d'onde, et donc des zones de plus forte densité de probabilité de présence de l'électron dans un état quasi lié de Stark pour un atome d'hydrogène.
Après cette grande première avec un atome d'hydrogène, les chercheurs ne comptent pas en rester là. Ils prévoient de faire d'autres expériences de visualisation de la fonction d'onde des électrons, non seulement dans des atomes, mais aussi des moléculesmolécules. En fait, ils sont déjà en train de faire des expériences similaires avec des atomes d'héliumhélium, et se proposent de réaliser des expériences avec un atome d'hydrogène plongé dans un champ magnétique.