au sommaire

Vue d’artiste du graphène déformé synthétisé par des chercheurs américains et japonais. Sa forme en selle de cheval est due à la présence de défauts dans l’habituelle structure en nid d’abeille du graphène, à cycles hexagonaux. Cette molécule comporte un cycle à 5 atomes de carbone et cinq cycles à 7 atomes. Des anomalies qui modifient ses propriétés. © Nature Chemistry
On connaît deux formes principales du carbone pur : le diamant (naturel pour les bijoux, synthétique pour les outils) et le graphite (dans la mine des crayons notamment). Cette seconde forme est composée de feuilles monoatomiques de graphènegraphène. Un matériau qui a le ventvent en poupe, car présenté comme miraculeux par des publications toujours plus nombreuses. Le graphène a même depuis peu son propre projet de recherche d'envergure, sobrement intitulé projet Graphène, et financé à hauteur d'un milliard d'euros sur dix ans par l'Union européenne.
Plus résistant que l'acier tout en étant plus léger, il est un meilleur conducteur électrique que le cuivre. Enroulés sur eux-mêmes, les feuillets de graphène donnent les fameux nanotubes de carbone. Des assemblages qui peuvent se comporter comme un métal ou comme un semi-conducteur, selon leur géométrie.
Ce matériau se présente sous la forme d'une feuille plane, car il est constitué de cycles à six atomesatomes de carbone, chaque atome étant relié à trois autres, dans une structure caractéristique en nid d'abeille. Le fait d'introduire des défauts dans la feuille de graphène, tels que des cycles non hexagonaux, mettrait à mal cette planéité. Si l'on découpait la feuille en petits morceaux (que l'on pourrait appeler « nanographènes »), quelle serait l'incidenceincidence des défauts sur les propriétés du nouveau composé ? C'est ce qu'ont voulu savoir des chercheurs de l'université de Nagoya, au Japon, et du Boston College, une université privée du Massachusetts. Ils livrent les résultats de leur démarche dans Nature Chemistry.
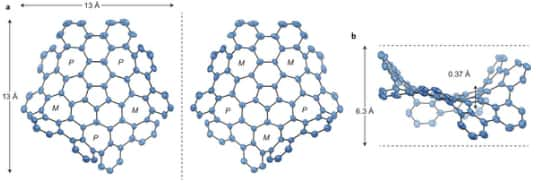
Les deux énantiomères (deux formes non superposables, images l'une de l'autre dans un miroir, sous laquelle se présentent certaines molécules) du graphène déformé, ainsi que ses dimensions, en angströms (10-10 m). On distingue les cinq cycles à 7 atomes de carbone ainsi que le cycle central à 5 atomes, qui distinguent ce composé du graphène plan et lui confèrent des caractéristiques propres. © Nature Chemistry
Des propriétés nouvelles apparaissent
Les chercheurs sont partis du corannulène, une moléculemolécule à la structure concaveconcave qui rappelle le bouton d'or. Il forme une sorte de couronne de cinq cycles à six atomes de carbone. Le composé final, baptisé graphène déformé par les auteurs, possède 80 atomes de carbone, et prend l'aspect d'une selle de cheval. Le pourtour de leur molécule est fermé par des atomes d'hydrogène. La distorsion résulte de la présence de cinq cycles à sept atomes autour du corannulène de départ, ainsi que d'un cycle à cinq atomes au centre.
Ces particularités ne font pas que déformer la structure carbonée : ils changent également les propriétés de l'ensemble, aussi bien physiquesphysiques qu'optiques ou encore électroniques. « Des mesures électrochimiques révèlent que les graphènes plats et déformés s'oxydent aussi facilement l'un que l'autre, mais que le graphène déformé résiste mieux à la réduction », précise Lawrence Scott, chimiste organicien au Boston College. En outre, le graphène déformé des chercheurs et le graphène classique (plan) n'ont pas la même couleurcouleur. Le premier est même nettement plus soluble dans les solvants organiques habituels que le second.
Il est encore trop tôt pour savoir si le composé particulier synthétisé par les scientifiques trouvera des applicationsapplications spécifiques. En revanche, ils ont prouvé qu'en ajoutant des défauts comme des cycles non hexagonaux dans la trame d'un nanographène, on pouvait atteindre un spectrespectre plus large de propriétés électroniques grâce aux nanotechnologies.