En 1848, le chimiste, cristallographe et physicien Louis Pasteur eut le premier l'intuition de l'existence de molécules chirales en observant au microscope des cristaux d'acide tartrique. Il en découvrit deux sortes, l'une à l'image de l'autre dans un miroir. Selon lui, la non-superposabilité de ces cristaux était due à la chiralité des molécules. Un siècle et demi plus tard, son confrère Cristobal Viedma (ici dans son laboratoire), inventait le moyen de produire spontanément un seul type de cristal et donc un même type de molécules chirales. © Universidad Complutense de Madrid
En 2005, le chimiste et cristallographe espagnol Cristobal Viedma a annoncé la découverte d'une méthode de synthèse permettant de fabriquer certaines molécules d'un même type de chiralité. Son résultat était tellement surprenant qu'il a eu du mal à le publier, rencontrant tout d'abord de l'incrédulité. Il s'agissait d'une découverte fondamentale de nature à jeter la lumière sur une énigme qui rend perplexes les chimistes et les biologistes depuis si longtemps : le problème de l'homochiralité.
Certaines molécules de même formule chimique brute peuvent en effet exister sous des formes symétriques l'une de l'autre dans un miroir. Elles ne peuvent être superposées, tout comme la main gauche diffère de la main droite. En chimie et en physiquephysique, cette dualité est dénommée la chiralité, chiral dérivant du mot grec χειρ, signifiant main.
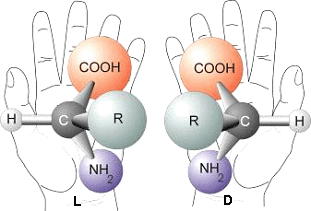
Deux molécules sont dites chirales lorsqu'elles sont l'image l'une de l'autre dans un miroir. Tout comme les mains, elles ne peuvent être superposées. On voit ici deux acides α-aminés avec leurs atomes de carbone, hydrogène, oxygène et azote (C, H, O, N) et un groupe moléculaire quelconque (R). © Société française d’exobiologie
Une asymétrie liée à l'origine de la vie
Les réactions chimiquesréactions chimiques habituelles ne font pas la différence entre les deux formes chirales d'une molécule. La symétrie miroir implique que la plupart des propriétés chimiques et physiques, comme le point de fusionfusion, la densité ou la solubilité, sont identiques pour un corps purcorps pur constitué de ces molécules. Dans des conditions normalesconditions normales, la synthèse chimique produit donc des quantités égales de molécules notées L et d'autres notée D. Le mélange est dit racémique.
Bizarrement, les molécules employées par tous les êtres vivants sur Terre sont toujours d'un même type de chiralité. Ainsi, les acides aminésacides aminés, constituant les protéinesprotéines du vivant, n'existent que sous la forme L, tandis que les sucressucres, par exemple présents dans l'ADNADN, sont eux uniquement de forme D. Comment expliquer cette asymétrie ? Plusieurs hypothèses ont été avancées.
L'une d'elles remonte à 1953 sous la plume du physicienphysicien britannique Frederick Charles Frank. Il a supposé l'existence d'une voie de synthèse foncièrement asymétriqueasymétrique encore inconnue. C'est précisément un exemple d'une telle voie que Cristobal Viedma a découvert il y a presque dix ans pour certaines molécules simples. Un mélange initialement racémique avec des cristaux dans une solution se trouvait mis dans une situation instable où un processus autocatalytique faisait disparaître un type de molécule chirale aux dépens de l'autre.
Des réactions de déracémisation
La réaction que le chercheur espagnol a découverte est devenue célèbre sous le nom anglais de « Viedma ripening » (ripening peut se traduire par maturation). Il ne lui a pas échappé qu'il tenait peut-être, avec ce procédé, les premiers éléments menant à la résolutionrésolution de l'énigme de l'homochiralité.
Aujourd'hui, des chercheurs néerlandais viennent de publier un article dans Nature Communications où ils annoncent qu'ils ont réussi à mener un processus de Viedma ripening avec des molécules ressemblant à des acides aminés. Cette performance ne concerne pas seulement les spécialistes en exobiologieexobiologie mais aussi les chercheurs de l'industrie pharmaceutique. En effet, l'un des types chiraux d'une molécule peut faire un bon médicament et l'autre un poison. C'est le cas de la thalidomide qui était utilisée sous forme racémique durant les années 1950 et 1960 comme sédatif et anti-nauséeux, en particulier chez les femmes enceintes. Or, on a découvert par la suite que ce médicament provoquait de graves malformations congénitalesmalformations congénitales.