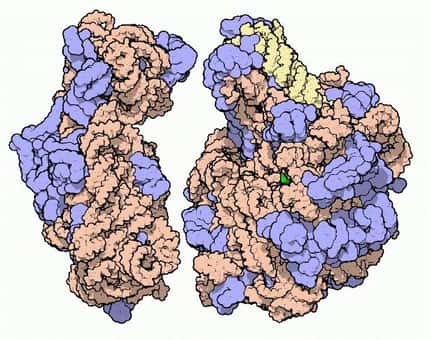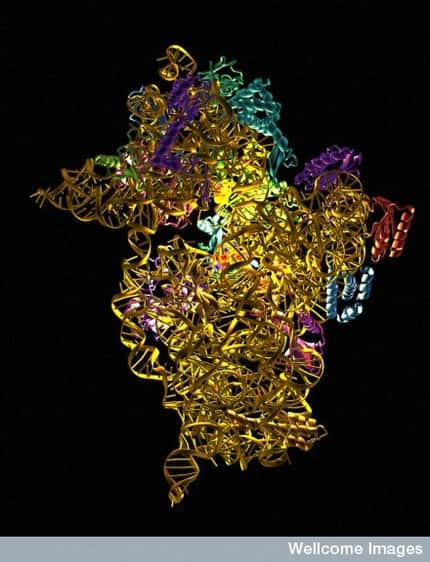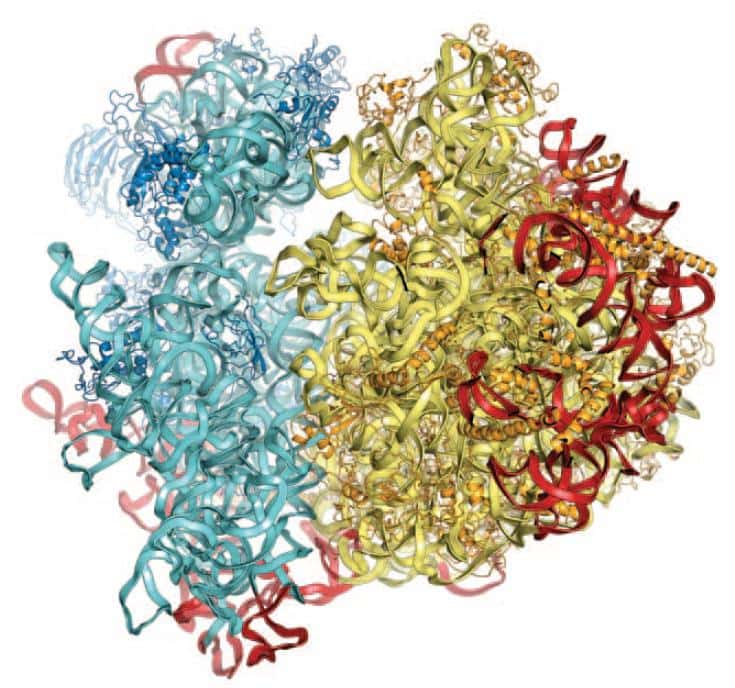
La structure du ribosome eucaryote a enfin pu être obtenue par diffraction aux rayons X, mais seulement avec une faible résolution. La sous-unité 40 S apparaît en bleu et la 60 S en jaune (les protéines sont plus foncées que les ARN). © M. Yusupov, Science
Le ribosome, siège de la traduction des ARN messagers en protéines, est le complexe nucléo-protéique cellulaire le plus impressionnant, et l'un des plus étudiés. Un prix Nobel avait d'ailleurs été accordé en 2009 à trois chercheurs américains et israéliens pour leurs travaux sur le ribosome bactérien. Ils avaient été les premiers à déterminer la structure de cet énorme complexe de 2,3 millions de daltons, soit l'équivalent de 2,3 millions d'atomesatomes d'hydrogènehydrogène.
Mais un défi encore plus intéressant restait à relever : déterminer la structure du ribosome d'eucaryote, 40 % plus volumineux que son homologue bactérien et devenu l'enjeu d'une concurrence mondiale féroce. Car depuis 40 ans, la composition moléculaire du ribosome était connue : deux grandes sous-unités indépendantes (60 S et 40 S selon leur coefficient de sédimentationsédimentation), contenant quatre ARN de 120 à 4.700 nucléotidesnucléotides, et près de 80 protéines. Mais la manière dont tous ces éléments s'assemblent n'était pas résolue.
Au cours de la dernière décennie, des premières images obtenues par cryomicroscopie électronique avait permis d'obtenir une idée de la structure, mais avec une faible précision. La revue Science a publié le 26 novembre la première structure aux rayons Xrayons X du ribosome d'un eucaryote, en l'occurrence la levurelevure Saccharomyces cerevisiaeSaccharomyces cerevisiae, réalisée par une équipe de recherche de l'Institut de génétique et de biologie moléculaire et cellulaire (IGBMC).
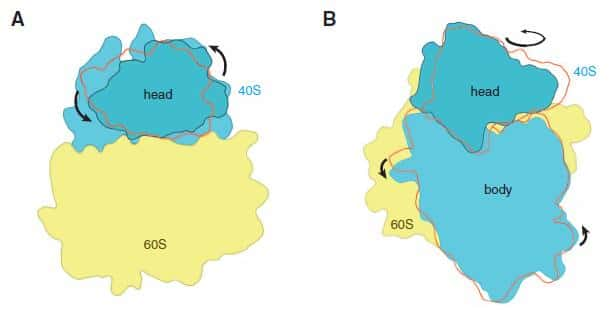
Les deux sous-unités du ribosome eucaryote subissent une rotation de l'une par rapport à l'autre lors de la synthèse protéique. © M. Yusupov, Science
Une image encore un peu floue
Généralement, afin d'observer les structures moléculaires à l'échelle atomique des protéines ou des acides nucléiquesacides nucléiques (ARN ou ADNADN), les chercheurs ont besoin non seulement d'une grande quantité de ces moléculesmolécules, mais aussi qu'elles soient d'une pureté optimale. Puisque les ribosomes sont impliqués dans la traduction, beaucoup d'entre eux sont couplés à des ARN messagers différents, ce qui entraîne une grande diversité de complexes ribosomes-ARN. Dans ces conditions, il n'est pas possible d'obtenir une image exploitable.
Pour résoudre ce problème, les scientifiques ont baissé la teneur en sucresucre du milieu de culture des levures. Sans cette source d'énergieénergie, les levures sont au repos et synthétisent beaucoup moins de protéines, laissant la majorité des ribosomes vacants. Les ribosomes purifiés ont pu ensuite être préparés, de manière à obtenir des cristaux, c'est-à-dire une multitude de ribosomes identiques et bien alignés.
La qualité des cristaux n'étant pas parfaite et les chercheurs ont dû se contenter d'une résolutionrésolution de 4,15 angströms (0,415 nanomètrenanomètre), ce qui ne permet pas de déterminer la position exacte de chaque atome, en particulier celle des chaînes latérales des acides aminés. La structure tridimensionnelle du ribosome n'est donc pas visualisée avec certitude. Cette imperfection n'est évidemment pas passée inaperçue dans la communauté scientifique, et notamment parmi les concurrents directs de l'équipe, qui n'ont donc pas encore totalement perdu la bataille.
Toutefois, cette vision approximative permet d'observer que les deux sous-unités du ribosome sont mobilesmobiles et pivotent l'une par rapport à l'autre au cours de la synthèse protéique. Mais pour en savoir plus, par exemple pour identifier des molécules capables d'interagir avec des sites actifssites actifs du ribosome, il sera nécessaire d'améliorer encore la résolution de la structure jusqu'à atteindre l'échelle atomique, ce que les scientifiques projettent de faire. Ils pourront également utiliser leur technique pour obtenir les structures des ribosomes d'autres eucaryotes et pourquoi pas celui de l'Homme.