au sommaire
Le virus du Sida sait s'adapter et devenir résistant aux molécules antivirales. Les chercheurs doivent donc être plus rapides que lui. Crédits DR
Pour lutter contre le virus du Sida, les trithérapies sont plutôt efficaces. C'est notamment grâce à des moléculesmolécules comme l'AZT (aussi appelée zidovudine ou azidothymidine), que l'espérance de vie des personnes contaminées par le VIH a augmenté depuis la découverte du virus.
L'AZT est un inhibiteur de la transcriptase inverse du virus. Celle-ci est une enzymeenzyme virale qui a pour but de rétro-transcrire l'ARNARN génomiquegénomique viral en ADNADN. Cette étape du cycle viral, qui se produit dans la capsidecapside, est cruciale puisque c'est elle qui lui permet ensuite de s'insérer dans le génomegénome des cellules infectées et de se multiplier. L'inhibitioninhibition de l'action de l'enzyme est donc délétère pour le virus et bénéfique pour le patient. L'AZT est notamment très efficace pour réduire la transmission du virus entre une mère et son enfant.
D'un point de vue moléculaire, l'AZT ressemble à un nucléotidenucléotide (elle dérive de la thymidinethymidine). Elle est de ce fait insérée dans la chaîne d'ADN en formation par la transcriptase inverse qui la confond avec un vrai nucléotide. Cette erreur induit l'arrêt de la synthèse d'ADN car elle ne possède pas le groupement hydroxyle (OH) sur le carbonecarbone 3' qui sert d'hameçon pour accrocher le nucléotide suivant.
Malheureusement, comme tous les virus à ARN, le VIH est capable d'acquérir des mutations et de devenir résistant aux molécules thérapeutiques, un peu comme le font les bactéries. Ainsi, il existe des souches de VIH devenues résistantes à l'AZT.
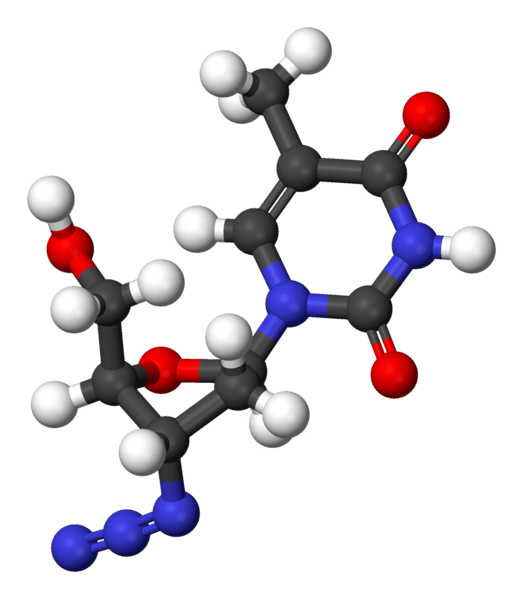
La molécule d'AZT ressemble beaucoup à un nucléotide. Ici, les atomes de carbone sont en noir, l'oxygène en rouge, l'azote en bleu et l'hydrogène en blanc. Crédits DR
L’AZT incorporée est ensuite éliminée
Mais le mécanisme de résistancerésistance était encore mystérieux. Il y a une dizaine d'années, des recherches avaient montré que la molécule d'ATPATP (la réserve d'énergieénergie de la cellule) était impliquée dans le phénomène. Un nouvel article paru dans le journal Nature Structural & Molecular Biology apporte aujourd'hui un éclairage supplémentaire.
Les chercheurs de l'université Rutgers (New Jersey) ont réussi l'exploit de déterminer par cristallographiecristallographie la structure moléculaire de cinq complexes différents. Ces complexes impliquent l'enzyme virale de la transcriptase inverse (sensible ou résistante à l'AZT), l'ADN, la molécule d'AZT et l'ATP.
En analysant les différentes structures obtenues, les chercheurs ont réalisé que l'AZT se fixait de la même façon aux enzymes sensibles et résistantes. La transcriptase inverse n'est donc pas dotée d'un mécanisme qui l'empêche de le confondre avec un vrai nucléotide. En fait, les mutations de l'enzyme résistante induisent une augmentation de l'affinité de l'enzyme pour l'ATP.
Plus précisément, la venue de l'ATP sur l'enzyme virale induit l'excisionexcision de l'AZT de la chaîne d'ADN en formation, sous la forme d'une molécule AZT-ATP particulière (avec quatre groupements phosphatephosphate : AZTppppA). L'ATP est donc capable d'éliminer l'AZT incorporée dans l'ADN, ce qui permet à la transcriptase inverse de reprendre la synthèse de l'ADN viral.
Cette compréhension du phénomène de résistance est importante d'un point de vue médical. Elle permet d'imaginer des traitements qui pourront inhiber la fixation de l'ATP sur la transcriptase inverse, ou d'améliorer la molécule d'AZT pour que cette excision ne puisse pas avoir lieu.