au sommaire

La biologiste Barbara Golden devant le complexe ARN-protéine. Crédit : Purdue Agricultural Communication/Tom Campbell
Le problème tient un peu de celui de l'œuf et de la poule. Qui donc est apparu le premier ? L'ADN, qui enregistre l'information pour fabriquer les protéines ? Ou bien l'ARN et la machinerie cellulaire pour réaliser cette fabrication avec les informations lues dans l'ADN ? Seul, l'ADN ne sert à rien, et, sans lui, la machine à fabriquer les protéines ne saura pas quelles moléculesmolécules construire.
Aujourd'hui, on a de bonnes raisons de penser que l'ARN, qui peut enregistrer de l'information tout comme l'ADN, a joué un rôle d'intermédiaire au tout début de la vie sur Terre, avant l'adoption générale de l'ADN. On parle même d'un « monde à ARN ». Cette molécule se serait liée à des protéines, capables de catalyser les réactions biochimiques, devenant donc ce que l'on appelle des enzymesenzymes. C'est une telle association qui vient d'être finement observée dans un champignonchampignon unicellulaire par une équipe américaine, qui publie ses résultats dans Nature.
Le champignon Neurospora crassa. Crédit : Purdue University Department de Biochemistry
« Il est hautement probable que l'ARN, ou une molécule similaire, a été une des premières molécules de la vie, transmettant le code génétique de génération en génération tout en se repliant au sein de la structure cellulaire de façon à pouvoir y fonctionner, avance la biologiste Barbara Golden, de la Purdue University, co-auteur de cette étude. A un certain moment, cette molécule d'ARN a évolué et est devenue capable d'utiliser les fonctions de certaines protéines. »
Les chercheurs ont utilisé comme une machine à remonter le temps l'ARN d'un champignon microscopique, en l'occurrence Neurospora crassa, de la division des Ascomycètes, un organisme simple déjà largement utilisé comme modèle. Son génome (comportant 43 mégabases et environ 10.000 gènesgènes) a été complètement séquencé le 23 avril 2003. Cet ARN a été cristallisé en compagnie d'une protéine, à laquelle il est intimement lié.
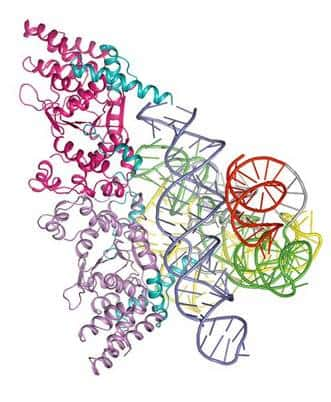
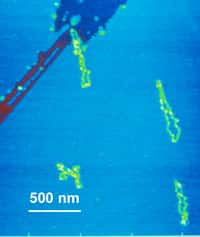
Sur la forme cristallisée de l'ARN fixé à sa protéine, les chercheurs ont pu étudier la structure de cette association. L'ARN est à droite et la protéine à gauche. Crédit : Barbara Golden, Purdue University Department de Biochemistry
Protéine à double face
Ce zoom a révélé deux informations capitales. Tel un masque à deux faces, la protéine de ce complexe présente deux parties, chacune lui donnant des propriétés différentes. Seconde découverte, alors que l'une de ces faces montre les caractéristiques d'une enzyme, l'autre semble lui permettre de jouer le rôle classique de l'ARN dans les organismes, à savoir la lecture du code génétique de l'ADN.
« Cette structure cristalline fournit une image instantanée qui explique comment, durant l'évolution, les protéines sont venues assister les molécules d'ARN pour les aider dans leurs fonctions biologiques, et finir par prendre en charge certains des rôles [de catalysecatalyse, NDLRNDLR] précédemment joués par l'ARN. » explique Barbara Golden.
Association entre une molécule d’ARN de champignon microscopique et une protéine, peut-être un moment-clé du passage de l’inanimé à la vie. Crédit Purdue University
« Evidemment, nous ne pouvons pas observer directement le passage de l'ARN au complexe ARN-protéine puis à l'ADN. Il nous faudrait pour cela une véritable machine à remonter le temps... tempère Barbara Golden. Mais en utilisant cette protéine de ce champignon, nous pouvons voir ce processus à l'œuvre aujourd'hui ».
Ce n'est pas la première fois que Lambowitz, Paukstelis et leur équipe de chercheurs de l'université du Texas s'intéressent à ce champignon. Ils en avaient déjà étudié une autre protéine et montré comment les processus biochimiques pouvaient progresser d'un monde ARN/protéine vers une structure d'ADN. Cette protéine stabilise l'ARN et lui permet de mieux se fixer à l'ADN au niveau d'un gène afin d'en réaliser une copie. Quant à l'ARN de ce complexe, il est capable, lui, de catalyser une certaine réaction chimiqueréaction chimique pourvu qu'il soit associé à sa protéine.
Ces études très fondamentales sur l'histoire de la vie pourraient aussi déboucher sur des applicationsapplications pratiques. Selon Alan Lambowitz, autre co-auteur, ces résultats ouvrent la voie au développement de médicaments antifongiquesantifongiques. Cette possibilité sera bientôt étudiée par l'équipe.