au sommaire
Le traitement de la grippe aviaire et des virus influenza
Le traitement de la grippe aviairegrippe aviaire se fait essentiellement par antivirauxantiviraux. On dispose actuellement en pratique clinique, de deux classes d'antiviraux qui agissent à des stades différents de la réplicationréplication virale (Oxford, Bossuyt et al. 2003 74) (Luscher-Mattli 2000 57) (Cooper, Sutton et al. 2003 27) (Monto, Osterhaus et al. 2003 67) (de Jong and Hien 2006 29).

Un antiviral pour le traitement de la grippe aviaire. © mecanopolis.org
La première génération est représentée par les inhibiteurs de la protéine virale M2.
- Mode d'action et indications
La protéineprotéine M2 agit comme une pompe à protons qui régule le pH interne du virus ; l'acidification du virus étant nécessaire à son encodage, le blocage de la protéine M2 entraîne l'arrêt de la réplication virale au stade précoce de l'infection.
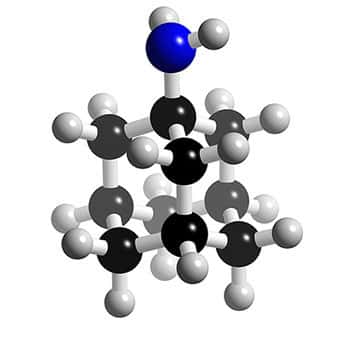
Structure 3D des inhibiteurs de la protéine M2 : l'amantadine. © 2005-2006 Karl Harrison, reproduction et utilisation interdites
Deux molécules dérivées de l'adamantane sont disponibles depuis une quarantaine d'années : l'amantadine et la rimantadine.
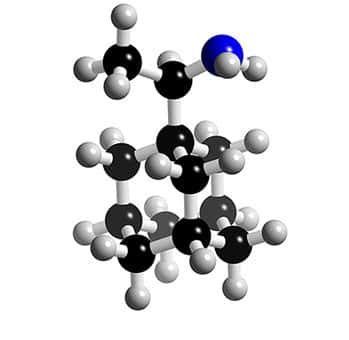
Structure 3D des inhibiteurs de la protéine M2 : la rimantadine. © 2005-2006 Karl Harrison, reproduction et utilisation interdites
Elles ont une action significative in vitroin vitro sur tous les virus influenzavirus influenza A, les infections expérimentales chez la souris et, chez l'homme, leur efficacité thérapeutique et prophylactique est démontrée dans les infections à virus A (H1N1), A (H2N2) et A (H3N2). L'apparition de résistancerésistance dans le traitement de la grippe commune est documentée (Masuda, Suzuki et al. 2000 60) (Fleming 2001 34). En pratique, les inhibiteurs de la protéine M2 ne sont pas utilisés actuellement dans le cadre des infections à virus influenza d'origine aviaire. Même si les études in vitro effectuées sur un isolat clinique A (H5N1H5N1) en 1997 ont montré la sensibilité du virus A (H5N1) à l'amantadine et la rimantadine (Subbarao, Klimov et al. 1998 89), les données sur leur activité sont trop peu nombreuses et leur toxicitétoxicité neurologique limite leur utilisation. La rimantadine est moins toxique que l'amantadine, mais elle est indisponible dans la plupart des pays, notamment en France.
- Résistance aux inhibiteurs de la protéine M2
Les déterminants moléculaires de la résistance à l'amantadine ont été identifiés au niveau de quatre régions du domaine transmembranaire de la protéine M2, correspondant aux acides aminésacides aminés 26, 27, 30, 31.
La fréquence de l'émergenceémergence de souches virales résistantes aux adamantanes varie selon le sous-type de l'hémagglutininehémagglutinine, la localisation géographique et la période étudiée. Elle est en augmentation chez les souches saisonnières (Bright, Medina et al. 2005 16). L'analyse de 60 et 74 virus aviaires à potentiel pandémique, isolés respectivement dans le sud-est asiatique et en Amérique du Nord, pendant les périodes 1979-1983 et 2000-2004 démontre l'apparition d'une résistance à l'amantadine et la rimantadine, pendant la seconde période, pour les sous-types H5, H9 des souches asiatiques. 31,1% des souches H5 et 10,6% des souches H9 portent des mutations caractéristiques au niveau du gènegène de la protéine M2. Seules 16,4% des souches H7 nord-américaines présentent des variations au niveau de M2 (Ilyushina, Govorkova et al. 2005 42). Les souches résistantes possèdent des substitutions d'acides aminés à l'une des trois positions identifiées : 27, 30, 31, la substitution en position 31 étant la plus fréquente.
Dans le cas du virus influenza A (H5N1), l'analyse des séquences aminoacides de la protéine M2 montre que tous les isolats viraux de génotypegénotype Z, circulant en 2003 et en 2004 en Thaïlande et au Vietnam montre une mutation correspondant à l'acide aminé en position 31 (substitution de la sérinesérine par l'asparagineasparagine) ; cette mutation confère invariablement la résistance à l'amantadine. La résistance est croisée avec les autres inhibiteurs de la pompe à protonsinhibiteurs de la pompe à protons M2 (Puthavathana, Auewarakul et al. 2005 78).
L'amantadine et la rimantadine ne sont pas une option thérapeutique valable dans le cadre des infections humaines dues au virus influenza A (H5N1).
Les inhibiteurs de la neuraminidase
- Mode d'action (Dreitlein, Maratos et al. 2001, 31)
Lors de la réplication, les nouvelles particules virales sont fixées à la surface cellulaire par une liaison entre l'hémagglutinine et les résidus d'acide sialique du récepteur cellulaire. Les inhibiteurs de la neuraminidaseneuraminidase bloquent la neuraminidase virale au niveau de son site de clivageclivage, empêchant la coupure de la liaison et la libération des virionsvirions qui restent attachés à la cellule. La réplication s'arrête. La conception de ces molécules est devenue possible avec la connaissance de la localisation précise et de la structure 3D du site catalytiquesite catalytique de l'enzyme. La cristallographiecristallographie a montré la conservation du site actifsite actif de l'enzyme et de sa séquence d'acides aminés dans les différents sous-types de la NA (Oxford, Bossuyt et al. 2003 74).
- Molécules
Le zanamivirzanamivir (Relenza®) est un dérivé de l'acide sialique par addition d'un groupement guanidino de charge positive ; il se fixe aux acides aminés chargés négativement du site actif de la neuraminidase virale et agit comme inhibiteur sélectif. Il a été synthétisé en 1989 et commercialisé en 1990. Il est administré directement dans les voies respiratoires, par inhalationinhalation. Des effets secondaires, à type de bronchospasme et altération de la fonction respiratoire, ont été signalés chez des patients porteurs de broncho-pneumopathiepneumopathie obstructive chronique et d'asthmeasthme. Sa voie d'administration limite son utilisation chez certains patients.
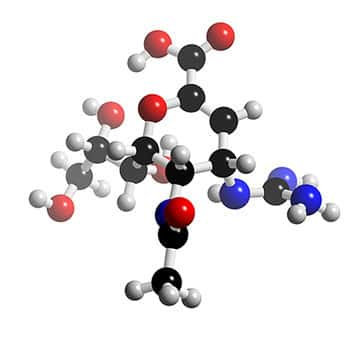
Structure 3D du zanamivir (Relenza®). © 2005-2006 Karl Harrison, reproduction et utilisation interdites
L'oseltamiviroseltamivir (Tamiflu®) est une molécule similaire, agissant au même site de fixation de la neuraminidase virale. A la place du groupe guanidino, il possède un groupement hydrophobehydrophobe qui se lie fortement à la région hydrophobe de l'enzyme et l'inactive. La nature hydrophobe de la molécule limite son absorptionabsorption gastrogastro-intestinale. Un promédicament administrable par voie orale, l'oseltamivir phosphatephosphate, a été synthétisé, par incorporation d'une chaîne lipophile dans la molécule ; après hydrolysehydrolyse par les estérases hépatiques, il se transforme en un métabolitemétabolite actif l'oseltamivir carboxylate (Oxford, Bossuyt et al. 2003 74).
- Activité de l'oseltamivir in vitro
La spécificité de l'oseltamivir pour les neuraminidases d'origine grippale est grande. Les tests de sensibilité in vitro ont démontré l'efficacité de la molécule sur les souches A (H5N1) et A (H9N2) circulant à Hong Kong en 1997 (Leneva, Roberts et al. 2000 53) et sur la souche A/Vietnam/1194/04 (H5N1) circulant actuellement dans le sud-est asiatique.
L'antiviral est actif, a priori, sur tous les sous-types de la NA, en raison du caractère hautement conservé du site actif de la neuraminidase virale.
- Activité de l'oseltamivir et du zanimivir chez l'animal in vivoin vivo
Des études chez la souris ont montré l'efficacité du zanamivir (par voie orale à des doses de 1 et 10 mg/kgkg/jour) et de l'oseltamivir (par inhalation) dans la préventionprévention et le traitement des infections expérimentales par les souches de virus influenza A/Hong Kong/156/97(H5N1) et A (H9N2) responsables des cas humains de grippe aviaire en 1997, à Hong Kong. La charge viralecharge virale est diminuée au niveau des poumonspoumons, et indétectable au niveau cérébral (Ward, Small et al. 2005 96) (Leneva, Roberts et al. 2000 53).
Une étude récente a démontré un effet dose réponse de l'oseltamivir dans l'infection expérimentale de la souris par une souche A/Vietnam/1203/04 (H5N1) isolée en 2004 au Vietnam chez un patient décédé. La survie est significativement augmentée pour une posologie de 10 mg/kg/jour pendant huit jours. La dose efficace prophylactique de l'infection par la souche A (H5N1) de 1997 ne protège pas de façon équivalente de la même dose contaminante de la souche virale A/Vietnam/1203/04(H5N1) (Yen, Monto et al. 2005 101).
- Données cliniques (Cooper, Sutton et al. 2003 27) (Roberts 2001 80) (McNicholl and McNicholl 2001 64) (Dreitlein, Maratos et al. 2001 31) (Kaiser 2001 46) (McClellan and Perry 2001 61) (McKimm-Breschkin 2005 63).
Des essais cliniques ont démontré l'efficacité du zanamivir et de l'oseltamivir dans le traitement des grippes saisonnières. On observe un raccourcissement de la duréedurée des symptômessymptômes, de trois à quatre jours, une diminution de la sévérité de la maladie, une baisse de la fréquence des complications, notamment des surinfections bactériennes des voies respiratoires basses (pneumoniespneumonies, bronchitesbronchites, otitesotites moyennes chez l'enfant), et par delà, une réduction de la prescription d'antibactériens et des hospitalisations (Oxford 2005 73).
Le facteur déterminant de l'efficacité est le délai d'initiation du traitement. Idéalement, il doit être instauré dans les 12 premières heures suivant l'apparition de la fièvrefièvre, auquel cas la maladie est raccourcie de plus de trois jours (Moscona 2005 68).
Dans la prise en charge des cas de grippe aviaire dus au virus A (H5N1), les patients reçoivent un inhibiteur de la neuraminidase. Il n'existe pas d'essais cliniques contrôlés qui pourraient avaliser les recommandations thérapeutiques qui se limitent à des extrapolations à partir des résultats des traitements de la grippe saisonnière. Au vu des données expérimentales récentes chez les mammifèresmammifères, la dose optimale et la durée du traitement ne sont pas vraiment codifiées, mais la souche circulant actuellement nécessite des doses plus importantes d'oseltamivir sur une plus longue durée par rapport à la souche isolée en 1997 (Yen, Monto et al. 2005 101).
L'OMS recommande le traitement par oseltamivir, à la dose de 75 mg chez l'adulte, deux fois par jour, pendant cinq jours et à doses adaptées en fonction du poids, chez l'enfant de plus de un an, ceci dans les formes modérées. Dans les formes graves, des doses de 150 mg/jour pendant sept à dix jours ont été suggérées, chez l'adulte, mais des études cliniquesétudes cliniques sont nécessaires. Le traitement doit débuter dans les 48 heures suivant l'apparition de symptômes pour espérer atteindre un bénéfice clinique notable. Le zanamivir en inhalation n'a jamais été utilisé dans les cas de grippe Agrippe A (H5N1).
En France, l'oseltamivir a une autorisation de mise sur le marchéautorisation de mise sur le marché pour le traitement de la grippe chez l'adulte et l'enfant de plus de un an, aux mêmes doses que celles définies ci-dessus.
Les données cliniques concernant l'utilisation de l'oseltamivir chez les premiers patients atteints par le virus influenza A (H5N1) au Vietnam, fin 2003, début 2004, ne sont pas concluantes : cinq patients sur dix furent traités, au mieux au cinquième jour de la maladie, trois d'entre eux sont décédés (Tran, Nguyen et al. 2004 93).
Les observations faites dans les 12 cas confirmés, entre janvier et mars 2004, en Thaïlande montrent que quatre des sept patients traités par oseltamivir qui ont récupéré, ont démarré le traitement plus tôt (en moyenne quatre jours et demi) que les patients décédés (neuf jours en moyenne) (Chotpitayasunondh, Ungchusak et al. 2005 23).
Aucune conclusion ne peut être tirée à ce jour quant à l'efficacité des inhibiteurs de la neuraminidase dans la grippe A (H5N1).
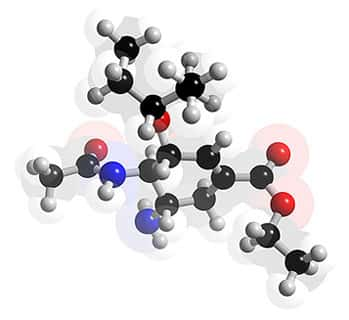
Structure 3D de l'oseltamivir (Tamiflu®). © 2005-2006 Karl Harrison, reproduction et utilisation interdites
- Effets secondaires
En général, le zanamivir est bien toléré (Cooper, Sutton et al. 2003 27) (Moscona 2005 68). Les premiers essais cliniques ont montré des effets secondaires mineurs, essentiellement respiratoires (sinusitessinusites) et gastro-intestinaux (nausées, diarrhéediarrhée) à des taux équivalents aux groupes placeboplacebo. Des rapports de pharmacovigilance ont signalé des cas de toux, de bronchospasme, d'altération de la fonction respiratoire chez des patients souffrant de maladies respiratoires chroniques (asthme, broncho-pneumopathies obstructives chroniques) (McNicholl and McNicholl 2001 64) (Dreitlein, Maratos et al. 2001 31). Son utilisation est déconseillée en cas de pneumopathie chronique. Plus récemment, un essai clinique en double aveugle, sur des patients hospitalisés pour grippe sévère a démontré l'excellente tolérance du zanamivir en inhalation (Ison, Gnann et al. 2003 44). Des manifestions cutanées à type de rash ont également été rapportées chez un patient porteur d'un carcinome hépatocellulairecarcinome hépatocellulaire (Kaji, Fukuda et al. 2005 47).
En 2003, une importante étude rétrospective a été publiée sur les effets secondaires de l'oseltamivir (Dutkowski, Thakrar et al. 2003 32) à partir de résultats d'essais cliniques, des données d'une compagnie d'assurance maladie américaine et des éléments de pharmacovigilance, portant sur plus de 11 000 patients et émanant d'Europe, d'Amérique du Nord et des pays de l'hémisphère sudhémisphère sud, sur une période de cinq ans. L'oseltamivir montre un profil de toxicité faible. Les effets indésirables se résument essentiellement en des troubles gastro-intestinaux (céphaléescéphalées, nausées, douleursdouleurs abdominales, vomissements, diarrhée) et des réactions cutanées à type de rash, d'urticaireurticaire, d'eczémaeczéma, quelques cas exceptionnels de syndromesyndrome de Stevens-Johnson et d'érythème polymorphe (Ward, Small et al. 2005 96) ; la responsabilité de l'oseltamivir dans ces manifestations cutanées n'est pas clairement établie, une étude antérieure avait conclu à son innocuité (Nordstrom, Oh et al. 2004 71). L'oseltamivir n'a pas d'incidenceincidence sur la fonction respiratoire, notamment chez les enfants asthmatiques.
La toxicité neurologique, peu évoquée jusqu'alors, à type de vertiges et d'insomniesinsomnies, a été signalée chez des handicapés mentaux (McGeer, Lee et al. 2004 62). Elle a récemment été posée dans le rapport du 18 novembre 2005 de l'Office des Médicaments Pédiatriques (Office of Pediatric Therapeutics), instance de la FDAFDA. (Agence américaine du médicament). Dans ce rapport, l'oseltamivir est mis en cause dans la mort de 12 enfants et dans la survenue de manifestations neuropsychiatriques à type d'hallucinationshallucinations, de confusion, de convulsionsconvulsions et de troubles du comportement ; des cas d'encéphaliteencéphalite sont cités.
Toutes ces complications sont répertoriées au Japon, le plus gros prescripteur mondial de Tamiflu (24 millions de doses) et s'inscrivent dans une période de surveillance renforcée des effets secondaires du médicament. Il est impossible pour le moment d'établir une relation directe entre ces complications et l'oseltamivir, la grippe étant responsable de manifestations neurologiques, certes rares, mais également graves voire mortelles. La FDA maintient la vigilance.
On ne dispose pas de données suffisantes actuellement, pour évaluer le risque tératogènetératogène de l'oseltamivir, ni sa toxicité au cours de l'allaitementallaitement : l'oseltamivir et son métabolite actif sont excrétés dans le lait chez la raterate allaitante, l'extrapolation à l'homme estime de 0,01 à 0,3 mg/jour respectivement les quantités excrétées dans le lait maternellait maternel (Ward, Small et al. 2005 96).
- Résistance aux inhibiteurs de la neuraminidase
Il n'y a aucune évidence de l'existence d'une résistance primaire à l'oseltamivir. Les tests réalisés sur les isolats cliniques avant tout traitement antiviral n'ont jamais montré d'altération de la sensibilité à l'oseltamivir. Les résistances apparaissent à une fréquence peu élevée pendant le traitement, et plutôt tardivement, jamais avant le quatrième jour, en concordance avec les études in vitro. Elles sont spécifiques du sous-type, la mutation H274Y est identifiée sur le gène N1, les mutations R292K et E119V sur le gène N2. Dans les échantillons cliniques, la population des virus sauvages domine toujours celle des virus porteurs de la mutation. L'évolution clinique des patients infectés par un virus résistant ne diffère pas de celle de patients atteints par un virus de type sauvage.
En juillet 2004, l'incidence de la résistance à l'oseltamivir a été estimée à 0,33 % chez l'adulte et l'adolescent, à 4 % chez l'enfant, avec un taux global de 1,26 % (Ward, Small et al. 2005 96).
Au Japon, des études récentes ont néanmoins rapporté des taux élevés de résistance, de l'ordre de 18 % et 16 % des cas pédiatriques traités par oseltamivir pour une grippe à A (H3N2) ou A (H1N1) ; ces taux pourraient s'expliquer comme le résultat d'une exposition à une dose d'antiviral insuffisante, favorisant l'apparition de résistance (Kiso, Mitamura et al. 2004 50).
L'analyse des séquences des gènes de la neuraminidase et les tests de sensibilité aux INA effectués sur des isolats cliniques humains A (H5N1) en 2005 au Vietnam, ont mis en évidence, chez un patient, un virus A/Hanoi/30408/2005 (H5N1) à phénotypephénotype mixte, correspondant à une population de virus de type sauvage et de virus résistants, présentant le phénotype 274Y, phénotype de résistance à l'oseltamivir. Le patient avait été traité par oseltamivir (de Jong, Tran et al. 2005 30). L'infection expérimentale de furets par des clonesclones viraux hautement résistants issus de la souche isolée a montré l'efficacité du zanamivir en diminuant la charge virale. Il n'y aurait pas de résistance croisée entre les INA (Le, Kiso et al. 2005 52).
La résistance des virus aux inhibiteurs de la neuraminidase (INA) peut s'acquérir par le biais de modification au niveau de la neuraminidase (NA) ou d'altération des propriétés de fixation de l'hémagglutinine au niveau des récepteurs cellulaires. Les mutations mises en évidence en pratique clinique correspondent à des substitutions des acides aminés en position 292 ou 119 sur la neuraminidase N2 ou en position 274 sur N1. H274Y correspond à la substitution de l'histidinehistidine par la tyrosinetyrosine, E119V, la substitution de l'acide glutamiqueacide glutamique par la valinevaline et R292K, la substitution de l'argininearginine par la lysinelysine.
Les capacités d'adaptation des virus porteurs de la mutation R292K sont réduites dans la grippe expérimentale H3N2 chez le furet et l'on n'observe aucune transmission avec les animaux contacts, dans des conditions où le type sauvage provoque une transmissibilité de 100% (Ward, Small et al. 2005 96). Par contre, les virus porteurs de la mutation E119V ou de la mutation H274Y infectent le furet et se transmettent aux animaux contacts ; cependant, dans ce dernier cas, la dose infectante est de 100 fois supérieure à celle de la souche sauvage et la transmission est plus lente (Herlocher, Truscon et al. 2004 41). Ces résultats ont été confirmés dans une étude récente, à l'aide de virus recombinants générés par génétiquegénétique inverse : la mutation R292K est associée à une diminution des capacités de réplication in vitro et de transmissibilité in vivo, alors que les virus présentant la mutation E119V ont une croissance et une capacité de transmission identiques à la souche sauvage (Yen, Herlocher et al. 2005 100)
En général, les substitutions au niveau de la neuraminidase virale s'accompagnent d'un déficit de la virulence dans les modèles animaux d'infection. En pratique clinique, le risque de transmission de virus résistant aux INA est faible. Il n'existe pas à ce jour de système de culture fiable pour le dépistagedépistage des résistances aux INA sur des isolats cliniques : le même virus peut, selon le type de culture dans lequel il est propagé, révéler un phénotype sensible ou résistant (Gubareva 2004 39).
Les traitements associés
Les antibactériens à large spectrespectre sont associés au traitement antiviral pour la prévention des surinfections bactériennes pulmonaires, et les corticoïdescorticoïdes sont utilisés fréquemment avec des résultats incertains qui nécessitent des essais cliniques approfondis afin d'établir des recommandations d'usage.
Perspectives thérapeutiques
- Le peramivir, inhibiteur de la neuraminidase, a des propriétés inhibitrices plus puissantes que l'oseltamivir et le zanamivir in vitro et in vivo chez la souris et le furet dans la prévention de l'infection expérimentale par le virus influenza A (Mishin, Hayden et al. 2005 66). Les essais cliniques phase I et II chez l'homme ont montré son excellente tolérance et une bonne efficacité en diminuant la charge virale après administration orale. Mais, en raison de sa faible biodisponibilitébiodisponibilité par voie orale, le développement de cette forme galénique a été stoppé et une forme à usage parentéralparentéral, par voie intramusculaire ou intraveineuse a donné d'excellents résultats et est en cours d'évaluation préclinique (Bantia, Arnold et al. 2005 9). Des essais cliniques phase I du péramivir par voie intraveineuse ont démarré en février 2006. En raison de la longueur des procédures d'autorisation de mises sur le marché, délivrées par la FDA américaine, il est prévu d'utiliser le péramivir uniquement dans le contexte d'une pandémiepandémie de grippe. L'administration par voie parentérale est particulièrement intéressante dans le cas de patients critiques, chez lesquels l'utilisation de la voie orale n'est pas possible (UPMC 2005 4).
- Les composés dimères du zanamivir, conjugués à des molécules de 14 à 18 atomesatomes au niveau du groupe hydroxyle en position C7, ont une activité antivirale jusqu'à 100 fois supérieure à celle du zanamivir in vitro et in vivo chez le rat, avec pour une dose unique, un maintien de taux thérapeutiques efficaces, de l'ordre d'une semaine, au niveau des tissus pulmonaires (Macdonald, Watson et al. 2004 59). D'autres dimères ont été synthétisés, par modification de la structure des molécules de liaison Ces nouvelles molécules ont démontré leur efficacité antivirale sur de nombreux types de virus influenza A, et pour certaines, sur la souche aviaire A (H5N1) isolée en 2004 au Vietnam (Macdonald, Cameron et al. 2005 58). Des trimères et tétramères du zanamivir ont été également synthétisés et testés avec succès pour certains d'entre eux, en raison de leur activité sur les virus grippaux A et B (Watson, Cameron et al. 2004 97).
- Les dérivés hétérocycliques de la thiourée ont montré des propriétés inhibitrices in vitro sur une souche A (H1N1) et pourraient représenter une nouvelle classe d'antiviraux (Sun, Huang et al. 2006 90).
- L'activité antineuraminidase des dérivés du cyclopentane fait l'objet d'études in vivo chez la souris, par voie orale et nasale (Chand, Babu et al. 2004 19) (Chand, Bantia et al. 2005 20).
- L'activité biologique de la viramidine (précurseur ou prodrogue de la ribavirineribavirine) a été étudiée sur un panel de virus influenza A (H1N1, H3N2, et H5N1) in vitro et in vivo chez la souris. Son efficacité est comparable à celle de la ribavirine (index thérapeutique équivalent), mais sa toxicité moindre, notamment hématologique, pourrait en faire un candidat potentiel dans le traitement de la grippe humaine (Sidwell, Bailey et al. 2005 86).
- Depuis sa découverte récente en 1998, l'interférenceinterférence par l'ARNARN a montré ses potentialités comme nouvelle classe d'antiviraux. L'interférence par l'ARN repose sur la propriété qu'ont des ARN double brindouble brin de dégrader les ARN simple brin présentant les mêmes séquences. Il suffit d'introduire dans les cellules des petits ARN double brin (ARN interférents) qui ont la même séquence que l'ARN messagerARN messager du gène à inhiber ; on dit qu'ils interfèrent avec l'ARN. L'utilisation d'ARN interférents, spécifiques de régions conservées des gènes de virus influenza A, en particulier, les nucléotidesnucléotides 1496 à 1516 de la nucléoprotéine NP, les nucléotides 2097-2107 de l'ARN transcriptases PA et les nucléotides 2257-2277 de la polymérasepolymérase PB1 a démontré une activité inhibitrice de la réplication virale in vitro (Bennink and Palmore 2004 12). Ces mêmes séquences ont un effet prophylactique et thérapeutique dans l'infection expérimentale par un virus grippal A chez la souris, en diminuant la charge virale au niveau des tissus pulmonaires (Ge, Filip et al. 2004 37) (Ge, Eisen et al. 2004 36) et protègent contre une dose contaminante létale de virus hautement pathogènespathogènes de sous-type H5 et H7 (Tompkins, Lo et al. 2004 92). Ces résultats sont plein de promesse pour le traitement d'infections virales émergentes ; l'optimisation des séquences cibles et des systèmes de délivrance est nécessaire.
- Les effets théoriques des inhibiteurs de protéasesinhibiteurs de protéases, antirétroviraux utilisés dans le traitement du sidasida, commencent à être explorés. Ils se basent sur l'existence probable d'une protéase à activité chymotrypsine-like dans la région C terminale de la sous-unitésous-unité PA de la RNA directed RNA polymerase des virus influenza de type A. Les inhibiteurs de protéases pourraient inhiber les fonctions protéolytiques ou endonucléolytiques de la sous-unité PA. Ces fonctions sont indispensables à la transcriptiontranscription de l'ARN viral en ARN messager et leur blocage entraîne une réduction de la réplication virale (Savarino 2005 83). Ces recherches sont à un stade embryonnaire et constituent une base à des études urgentes in vitro. La détermination de la structure 3D de la sous-unité PA par cristallographie est impérative au développement de molécules inhibitrices spécifiques.