au sommaire

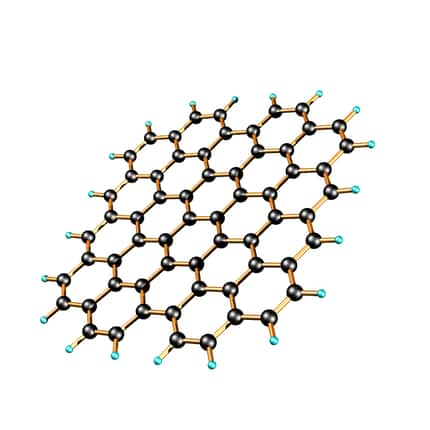
La structure 2D d'un feuillet de graphène. Ce matériau composé d'atomes de carbone aura probablement de nombreuses applications industrielles à moyen terme. © Jannik Meyer
Élément indispensable à la vie et en chimie organique, le carbone forme plus de composés que tous les autres éléments chimiques réunis.
Généralités
- Symbole : C
- Numéro atomique : 6
- Électrons par niveau d'énergie : 2, 4
- Masse atomique : 12,011 u
- IsotopesIsotopes les plus stables : 12C stable avec six neutronsneutrons (98,93 %), 13C stable avec sept neutrons (1,07 %)
- Série : non-métauxmétaux
- Groupe, période, bloc : 14, 2, p
- Densité : entre 1,8 (carbone amorpheamorphe) et 3,5 (diamantdiamant)
- Point d'ébullition : 3.825 °C (sublimationsublimation)
Historique du carbone
« Carbone » provient du latin carbo, qui signifie « charboncharbon ». Sous forme de suiesuie et de charbon de boisbois, le carbone est connu depuis la Préhistoire. En 1772, Lavoisier démontra que le diamant est une forme de carbone. Il en sera de même pour le graphitegraphite en 1779 par Carl Wilhelm Scheele. C'est à nouveau Lavoisier qui répertoria le carbone comme un élément dans ses œuvres dès 1789.

Le carbone est un élément central dans la vie sur Terre, aussi bien pour les végétaux que pour les animaux. © Elle EPP, Flickr, CC by-nc-sa 2.0
Propriétés du carbone
Le carbone cristallin pur existe dans la nature sous forme de diamant et de graphite. Le carbone élémentaire est inerte et insoluble dans l'eau ou les solvantssolvants organiques. À haute température, il s'oxyde pour former du monoxyde et du dioxyde de carbonedioxyde de carbone.
Nous connaissons plus d'un million de composés qui possèdent du carbone lié à l'hydrogènehydrogène, ainsi qu'un grand nombre de composés inorganiques qui contiennent du carbone. On retrouve le carbone lié à l'hydrogène notamment dans toutes les plantes et tous les animaux. Les dépôts de matièrematière organique issue du vivant fossilisent pour donner divers hydrocarbureshydrocarbures. Les carbonates sont inclus dans de nombreux minérauxminéraux, le gypsegypse et le marbremarbre pour ne citer qu'eux.
Utilisation du carbone
Sous la forme d'élément libre, le carbone présent dans le diamant sert en joaillerie et dans l'industrie pour sa duretédureté. Le graphite est employé comme lubrifiantlubrifiant, pour fabriquer des creusets et se retrouve aussi dans les mines de crayon.
Sous forme composée, les applicationsapplications du carbone sont très nombreuses. Le CO2, par exemple, est notamment employé dans les boissons (pour ajouter des bulles de gazgaz), dans les extincteurs, ou encore comme réfrigérant, sous forme de glace sècheglace sèche, dans l'industrie des semi-conducteurssemi-conducteurs. Le monoxyde de carbonemonoxyde de carbone (CO) sert de gaz réducteur dans beaucoup de processus industriels. De nombreux carburescarbures métalliques sont appréciés pour leur grande résistancerésistance à la chaleurchaleur. Le tétrachlorure de carbone (CCl4) et le disulfure de carbone (CS2) sont d'importants dissolvants. Le chlorofluorocarbure (CCl2F2), aussi appelé FréonFréon R12, est un gaz employé dans les systèmes de refroidissement.
Effets du carbone sur la santé
Le carbone peut être dangereux sous certaines formes non élémentaires. L'inhalationinhalation chronique de charbon noir peut causer des dommages de gravitégravité variée aux poumonspoumons comme au cœur. Le carbone 14, radioactif, peut induire un risque accru de cancercancer, car il peut se lier organiquement aux cellules de l'organisme.
Le disulfure de carbone (CS2) est un liquideliquide extrêmement toxique utilisé pour la vulcanisationvulcanisation. Le monoxyde de carbone peut provoquer l'empoisonnement de l'hémoglobinehémoglobine en cas d'inhalation prolongée. On trouve aussi le carbone dans les ionsions cyanure (CN-). Les composés qui en contiennent sont hautement toxiques. Quant à l'éventuelle toxicitétoxicité des nouvelles formes de carbone comme les nanotubesnanotubes (des feuilles de graphènegraphène roulés en cylindres) et le fullerènefullerène, elle est actuellement étudiée.